题目内容
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10﹣amolL﹣1,c(OH﹣)=10﹣bmolL﹣1,已知a+b=12,则:
(1)该温度下水的离子积常数KW=_______;
(2)该NaOH溶液的物质的量浓度的精确值是______molL﹣1;
(3)在该温度下,将100mL 0.1molL﹣1的稀硫酸与100mL 0.4molL﹣1的NaOH溶液混合后,溶液的pH=______;
(4)该温度下若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前 a与b之间应满足的关系是______。
【答案】10﹣12 10﹣b﹣10﹣a 11 a+b=14
【解析】
(1)该温度下,水的离子积常数Kw=c(H+)·c(OH-);
(2)该NaOH溶液的物质的量浓度的精确值=c(OH-)-c(H+);
(3)将100mL0.1molL-1的稀硫酸与100mL0.4molL-1的NaOH溶液混合后,溶液显碱性,首先计算混合溶液中c(OH-),在根据Kw计算c(H+),最后根据pH=-lgc(H+)计算;
(4)溶液呈中性,说明酸中n(H+)等于碱中n(OH-)。
(1)在t℃时,某NaOH稀溶液中,c(H+)=10-amolL-1,c(OH-)=10-bmolL-1,已知a+b=12,则该温度下水的离子积常数Kw=c(H+)·c(OH-)=10-(a+b)=10-12,故答案为:10-12;
(2)氢氧化钠溶液中氢氧化钠和水均能电离出氢氧根离子,只有水电离出氢离子,因此该NaOH溶液的物质的量浓度的精确值=c(OH-)-c(H+)=(10-b-10-a)mol/L,故答案为:(10-b-10-a);
(3)在该温度下,将100mL0.1molL-1的稀硫酸与100mL0.4molL-1的NaOH溶液混合后,反应后氢氧化钠过量,混合溶液中c(OH-)=![]() =0.1mol/L,c(H+)=
=0.1mol/L,c(H+)=![]() =
=![]() mol/L=10-11molL-1,溶液的pH=-lgc(H+)=-lg10-11=11,故答案为:11;
mol/L=10-11molL-1,溶液的pH=-lgc(H+)=-lg10-11=11,故答案为:11;
(4)该温度下若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,说明酸中n(H+)等于碱中n(OH-),即100×10-a=1×10b-12,则a+b=14,故答案为:a+b=14。

【题目】某物质 A 是 B(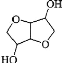 )的同分异构体,7.30 g 的 A 与足量饱和碳酸氢钠可释放出 2.24L 二氧化碳(标准状况),A 的可能结构共有( )种(不考虑立体异构)
)的同分异构体,7.30 g 的 A 与足量饱和碳酸氢钠可释放出 2.24L 二氧化碳(标准状况),A 的可能结构共有( )种(不考虑立体异构)
A.8B.9C.10D.11
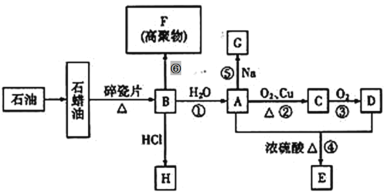
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。某小组利用乙醛液相硝酸氧化法制备乙二醛并测定乙二醛纯度,装置如图所示:
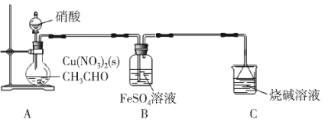
已知:①NO+FeSO4=FeSO4·NO(棕色)。
②几种有机物的部分性质如表所示:
乙醛 | 乙二醛 | 乙二酸 | 乙酸 | |
沸点/℃ | 20.8 | 50.5 | 109 | 117.9 |
溶解性 | 与水、有机溶剂互溶 | 溶于水、乙醇等 | 溶于水和有机溶剂 | 与水、乙醇互溶 |
密度/gcm-3 | 0.78 | 1.27 | 1.90 | 1.05 |
相对分子质量 | 44 | 58 | 90 | 60 |
实验步骤:
①取20 mL乙醛装于烧瓶,加入2 g Cu(NO3)2粉末作催化剂,向烧瓶中缓慢滴加2 mol·L-1硝酸至乙醛完全反应为止;
②提纯产品,最终得到10.0 mL产品。
请回答下列问题:
(1)盛装硝酸的仪器名称是___________。
(2)实验中,观察到装置B中溶液变为棕色,制备乙二醛的化学方程式为________________。
(3)向烧瓶中滴加硝酸要“缓慢”,其目的是___________;判断烧瓶中制备乙二醛的反应已完成的标志是___________。
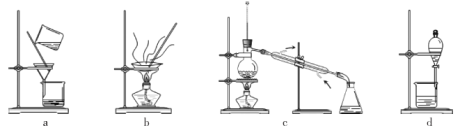
(4)分离提纯产品,宜选择下列装置___________(填字母)。
(5)根据上述实验数据,该实验中乙二醛的产率约为___________(填字母)。
a.56.5% b.61.8% c.67.9% d.72.6%
(6)实验室可用酸性KMnO4溶液测定乙二醛的纯度,发生反应的离子方程式为:18H++6MnO4-+5C2H2O2→10CO2↑+6Mn2++14H2O。实验步骤如下:取V mL产品,加蒸馏水稀释至250 mL,量取25.00 mL稀释后的溶液于锥形瓶,滴加5.00 mL稀硫酸,用c mol·L-1 KMnO4溶液,三次平行实验消耗KMnO4溶液体积如下:
实验 | Ⅰ | Ⅱ | Ⅲ |
V[KmnO4(aq)]/mL | 20.05 | 22.40 | 19.95 |
滴定终点的标志是___________;该产品纯度为___________g·mL-1(用含V和c的代数式表示)。