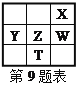
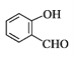
题目内容
【题目】已知水电离平衡如图所示,且pOH=-lg c(OH-)。下列说法错误的是
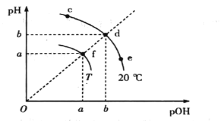
A.各点对应的水的离子积:Kw(f)>Kw(e)=Kw(d)
B.加热f点纯水,其组成由f点沿fd直线向d方向迁移
C.向c点溶液中通入少量HCl,其组成由c点沿cde曲线向e点移动
D.df直线上各点对应的水溶液(或纯水)一定显中性
【答案】B
【解析】
pOH=-lg c(OH-),f点氢离子浓度、氢氧根离子浓度大于d点,所以T温度下水的离子积常数大于20℃时水的离子积常数,T大于20℃。
A. 同一条曲线上的点水的离子积相同, f点氢离子浓度、氢氧根离子浓度大于d点,所以Kw(f)>Kw(d),各点对应的水的离子积:Kw(f)>Kw(e)=Kw(d),故A正确;
B. 加热促进水电离,氢离子浓度增大,加热f点纯水,其组成由f点沿fd直线向原点方向迁移,故B错误;
C. 向c点溶液中通入少量HCl,氢离子浓度增大,氢氧根离子浓度减小,Kw不变,其组成由c点沿cde曲线向e点移动,故C正确;
D. df直线上各点,氢离子浓度等于氢氧根离子浓度,对应的水溶液(或纯水)一定显中性,故D正确。
选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】草酸![]() 溶液与酸性
溶液与酸性![]() 溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
(查阅资料)![]() 溶液氧化
溶液氧化![]() 的反应历程为:
的反应历程为:
![]()
(提出假设)假设1:该反应为放热
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是______。
(设计、完成实验)
![]() 称取______g草酸晶体
称取______g草酸晶体![]() ,配置500mL
,配置500mL![]()
![]() 溶液。
溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和______。
②下列操作会使所配溶液浓度偏低的是______![]() 填下列选项的字母序号
填下列选项的字母序号![]() 。
。
A 称取草酸晶体时,将草酸晶体放在托盘天平右盘
B 定容时俯视刻度线
C 将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D 摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
![]() 完成探究,记录数据
完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量 | 控制条件 | 溶液褪 色时间
| |||
| 等浓度
|
|
稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度 | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量 |
|
4 | 30 | 20 | x | 20 | 加入5mL
| 18 |
则![]() ______,假设______成立。
______,假设______成立。
![]() 由于
由于![]() 能氧化水中有机物等因素,配置好稳定的
能氧化水中有机物等因素,配置好稳定的 溶液,其浓度需标定.取
溶液,其浓度需标定.取![]()
![]()
![]() 溶液于锥形瓶中,加入10mL
溶液于锥形瓶中,加入10mL![]() 稀硫酸,用
稀硫酸,用![]() 中
中![]() 溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗
溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗![]() 溶液
溶液![]() ,则草酸溶液与酸性
,则草酸溶液与酸性![]() 溶液反应的离子方程式为:______,上述实验中
溶液反应的离子方程式为:______,上述实验中![]() 溶液的物质的量浓度为______。
溶液的物质的量浓度为______。