题目内容
【题目】某同学设计如下实验方案以分离KCl和BaCl2两种固体混合物,供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、硫酸、盐酸
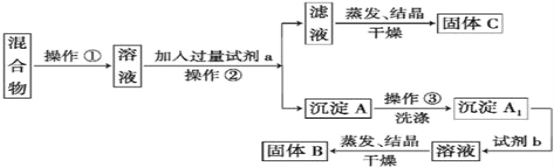
(1)操作①的名称是 ,操作②的名称是 。
(2)试剂a是 ,试剂b是 (填化学式)。
(3)加入试剂b所发生反应的离子方程式为 。
(4)该方案能否达到实验目的(填能或不能) .若不能,应如何改进(若能,此问不用回答) 。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是 。
A、固体C的质量 B、沉淀A的质量
C、沉淀A1的质量(未干燥) D、固体B的质量
【答案】(1)溶解(1分)过滤(1分)
(2)K2CO3(1分)HCl(1分)
(3)BaCO3+2H+=Ba2++CO2↑+H2O(2分)
(4)不能(1分)应在操作②的滤液中加入过量盐酸后再蒸发结晶(2分)(5)D(2分)
【解析】
试题分析:混合物溶于水制成溶液,要实现氯化钾和氯化钡的分离,需要把氯化钡转化为碳酸钡,然后碳酸钡与盐酸反应转化为氯化钡,所以试剂a是碳酸钾,产生的碳酸钡沉淀通过过滤除去,滤液加入盐酸后,蒸发、结晶即得到氯化钾。沉淀与盐酸反应生成氯化钡,蒸发结晶得到氯化钡。
(1)根据以上分析可知操作①的名称是溶解,操作②的名称是过滤,(2)试剂a是K2CO3。试剂b是盐酸,(3)加入试剂b所发生反应的化学方程式为BaCO3+2HCl=BaCl2+CO2↑+H2O。(4)操作②的滤液中含有剩余的氯化钾及K2CO3溶液、若要直接蒸发结晶得到的氯化钾不纯,必须除去碳酸钾,需要加入足量的盐酸;答案不能, 应在操作②的滤液中加入过量盐酸后再蒸发结晶;(5)准确称量KCl和BaCl2两种固体混合物的质量,还应当直到硫酸钡沉淀的质量,就能求出BaCl2质量,进而求出其质量分数;

【题目】

(1)该硫酸的物质的量浓度是____________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需用490 mL 4.6 mol/L的稀硫酸,则要量取该硫酸的体积为_____________mL。
(3)按题(2)的要求配制溶液时,右图中肯定不需要用到的实验仪器是________(填仪器序号),所需的玻璃仪器中,除量筒、烧杯、玻璃棒和胶头滴管之外,还需要_______________(填仪器名称)。

(4)在下列配制过程示意图中,有错误的是(填写序号) __________________。

(5)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是 。
A.未经冷却趁热将溶液注入容量瓶中 |
B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 |
D.摇匀后发现液面低于刻度线继续加水定容 |
(6)用配制好的4.6 mol/L的稀硫酸溶液,再来配制50ml 1.4mol/L的H2SO4溶液,需要取配好的溶液_______________ml.