题目内容
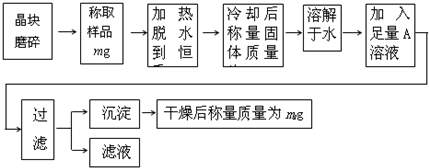
为了测定混有少量KCl杂质的明矾KAl(SO4)2?nH2O的纯度,同时测定n的值,按下列流程进行实验:

(1)称量样品需用托盘天平,下列有关使用托盘天平的叙述,不正确的是
A、称量前先调节托盘天平的零点
B、称量时左盘放被称量物,右盘放砝码
C、潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
D、用托盘天平可以准确称量至0.01克
E、称量完毕,应把砝码放回砝码盒中
(2)判断已脱水至恒重的方法是
A、长时间加热 B、两次称量的质量必须一样
C、观察有水蒸气不再冒出 D、两次称量的质量差不超过0.1g
(3)在加热结束后,冷却固体的操作为
(4)A溶液是
(5)通过实验,测得明矾化学式中n值为12,则明矾的纯度为
%.(已知KAl(SO4)2?12H2O的式量为474)

(1)称量样品需用托盘天平,下列有关使用托盘天平的叙述,不正确的是
C、D
C、D
.A、称量前先调节托盘天平的零点
B、称量时左盘放被称量物,右盘放砝码
C、潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量
D、用托盘天平可以准确称量至0.01克
E、称量完毕,应把砝码放回砝码盒中
(2)判断已脱水至恒重的方法是
D
D
A、长时间加热 B、两次称量的质量必须一样
C、观察有水蒸气不再冒出 D、两次称量的质量差不超过0.1g
(3)在加热结束后,冷却固体的操作为
用坩埚钳把坩埚移到干燥器中冷却
用坩埚钳把坩埚移到干燥器中冷却
;(4)A溶液是
BaCl2(其它试剂只要合理也可以)
BaCl2(其它试剂只要合理也可以)
(填化学式),判断A溶液是否足量的方法是静置给上层清液滴加适量A观察有无沉淀产生
静置给上层清液滴加适量A观察有无沉淀产生
;(5)通过实验,测得明矾化学式中n值为12,则明矾的纯度为
| 23700m2 |
| 233m |
| 23700m2 |
| 233m |
分析:(1)使用托盘天平时,无论称量任何药品都要放在质量大小相等的纸片上或小烧杯中,不能直接放在托盘上称量,托盘天平精确到0.1,只能粗略称量;
(2)当两次称量的质量差不超过0.1g时,可认为加热至恒重,完全脱水;
(3)为防止固体吸收空气中的水而重新生成结晶水合物,应在干燥管中冷却;
(4)检验样品的纯度,可加入氯化钡溶液,根据生成硫酸钡的质量测定样品的纯度,判断溶液是否足量的方法是静置给上层清液滴加适量A观察有无沉淀产生;
(5)根据生成硫酸钡的质量计算明矾的质量,从而计算样品的纯度.
(2)当两次称量的质量差不超过0.1g时,可认为加热至恒重,完全脱水;
(3)为防止固体吸收空气中的水而重新生成结晶水合物,应在干燥管中冷却;
(4)检验样品的纯度,可加入氯化钡溶液,根据生成硫酸钡的质量测定样品的纯度,判断溶液是否足量的方法是静置给上层清液滴加适量A观察有无沉淀产生;
(5)根据生成硫酸钡的质量计算明矾的质量,从而计算样品的纯度.
解答:解:(1)A、用托盘天平称量药品质量时,要先调节托盘天平的零点,使左右平衡,故A正确;
B、称量时应将药品放在左盘,砝码放在右盘,故B正确;
C、使用托盘天平时,无论称量任何药品都要放在质量大小相等的纸片上或小烧杯中,不能直接放在托盘上称量,故C错误;
D、托盘天平精确到0.1,只能粗略称量,故D错误;
E、称量完毕,为防止砝码生锈,应把砝码放回砝码盒中,故E正确.
故答案为:C、D;
(2)A、药品不能长时间加热,否则会使药品分解而变质,故A错误;
B、称量时一定会存在误差,两次称量的结果不可能一样,故B错误;
C、加热至一定程度时,不能看见有气体生成,不能作为判断的依据,故C错误;
D、当两次称量的质量差不超过0.1g时,可认为加热至恒重,完全脱水,故D正确.
故答案为:D;
(3)为防止固体吸收空气中的水而重新生成结晶水合物,应在干燥管中冷却,注意用坩埚钳夹持,
故答案为:用坩埚钳把坩埚移到干燥器中冷却;
(4)检验样品的纯度,可加入氯化钡溶液,根据生成硫酸钡的质量测定样品的纯度,判断溶液是否足量的方法是静置给上层清液滴加适量A观察有无沉淀产生,
故答案为:BaCl2(其它试剂只要合理也可以);静置给上层清液滴加适量A观察有无沉淀产生;
(5)干燥后生成硫酸钡的质量为m2g,则硫酸钡的物质的量为
=
mol,则KAl(SO4)2?12H2O的质量为
×
mol×474g/moL=
g,所以明矾的纯度为
×100%=
%.
故答案为:
%.
B、称量时应将药品放在左盘,砝码放在右盘,故B正确;
C、使用托盘天平时,无论称量任何药品都要放在质量大小相等的纸片上或小烧杯中,不能直接放在托盘上称量,故C错误;
D、托盘天平精确到0.1,只能粗略称量,故D错误;
E、称量完毕,为防止砝码生锈,应把砝码放回砝码盒中,故E正确.
故答案为:C、D;
(2)A、药品不能长时间加热,否则会使药品分解而变质,故A错误;
B、称量时一定会存在误差,两次称量的结果不可能一样,故B错误;
C、加热至一定程度时,不能看见有气体生成,不能作为判断的依据,故C错误;
D、当两次称量的质量差不超过0.1g时,可认为加热至恒重,完全脱水,故D正确.
故答案为:D;
(3)为防止固体吸收空气中的水而重新生成结晶水合物,应在干燥管中冷却,注意用坩埚钳夹持,
故答案为:用坩埚钳把坩埚移到干燥器中冷却;
(4)检验样品的纯度,可加入氯化钡溶液,根据生成硫酸钡的质量测定样品的纯度,判断溶液是否足量的方法是静置给上层清液滴加适量A观察有无沉淀产生,
故答案为:BaCl2(其它试剂只要合理也可以);静置给上层清液滴加适量A观察有无沉淀产生;
(5)干燥后生成硫酸钡的质量为m2g,则硫酸钡的物质的量为
| m2g |
| 233g/mol |
| m2 |
| 233 |
| 1 |
| 2 |
| m2 |
| 233 |
| 237m2 |
| 233 |
| ||
| mg |
| 23700m2 |
| 233m |
故答案为:
| 23700m2 |
| 233m |
点评:本题考查物质的组成和含量的测定,题目较难,本题注意实验的原理和操作方法的注意事项.

练习册系列答案
相关题目