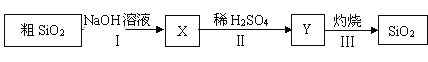
题目内容
【题目】W.X.Y.Z.Q五种元素的原子序数依次增大。其中X原子的价电子构型为nsnnpn,Y原子的L电子层中,有三个未成对的电子,且无空轨道;W.Z的原子序数相差18,且Z原子的第一电离能在同周期中最低,Q+中所有电子正好充满K.L.M三个电子层,请回答下列问题:
(1)写出Y3-离子的电子排布式________。
(2)Y.Z.Q电负性由小到大的顺序是________。(填元素符号)
(3)已知Y的氢化物能与Q2+形成配离子[Q(YH3)4]2+,该配离子中存在的化学键有________。(填标号)
A.氢键 B离子键 C.共价键 D.配位键
(4)Q与某非金属原子A形成的晶体结构如图所示。该晶体的化学式是________,与同一个A微粒距离最近的Q微粒有________个。

【答案】 1S22S22P6 N > Cu > K CD CuA 4
【解析】试题X原子的价电子构型为nsnnpn,n=2,所以X是C元素;Y原子的L电子层中,有三个未成对的电子,且无空轨道,电子排布是1S22S22P3,Y是N元素;W、Z的原子序数相差18,且Z原子的第一电离能在同周期中最低,W是H元素、Z是K元素;Q+中所有电子正好充满K.L.M三个电子层,Q是29号元素Cu。
解析:根据以上分析,(1)N3-核外有10个电子,电子排布式是1S22S22P6。
(2)非金属性越强电负性越强,金属性越强电负性越小,所以N、K、Cu电负性由小到大的顺序是N > Cu > K。(3)已知氨气能与Cu2+形成配离子[Cu(NH3)4]2+,该配离子中Cu与 NH3之间是配位键、NH3中存在共价键,所以化学键有CD;(4)根据均摊原则Cu原子数是4,A原子数是![]() ,该晶体的化学式是CuA,根据图示,与同一个A微粒距离最近的Q微粒有4个。
,该晶体的化学式是CuA,根据图示,与同一个A微粒距离最近的Q微粒有4个。

【题目】在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4(s) 时刻测得各物质的浓度如下表。下列结论正确的是
测定时刻/s | t1 | t2 | t3 | t4 |
c(A) / (mol·L-1) | 6 | 3 | 2 | 2 |
c(B) / (mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C) / (mol·L-1) | 1 | 2.5 | 3 | 3 |
A. 在t3时刻反应已经停止
B. t3~t4内正、逆反应速率不相等
C. 在容器中发生的反应为A + B![]() C
C
D. 在t2~t3内A的平均反应速率为![]() mol·L-1·s-1
mol·L-1·s-1