题目内容
【题目】下图是元素周期表的一部分,表中所列的字母分别代表某一化学元素。

完成下列填空(填元素符号或化学式):
(1)上图中元素C在周期表中的位置是___________,G和I形成的化合物不止一种,其中一种物质中各原子最外层均达到8电子稳定结构,请写出其电子式______________。
(2)请按照由大到小的顺序写出B、C、D的简单离子的离子半径大小顺序_______(用离子符号表示),上述元素中最高价氧化物对应的水化物中酸性最强的物质的化学式为___________ 。
(3)请写出D的最高价氧化物对应的水化物和F的单质反应时的离子方程式____________。
(4)元素周期表位于对角线的两种元素其性质相似称之为对角线规则。根据周期表对角线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。则鉴别Be(OH)2和Mg(OH)2可选用的试剂为NaOH溶液,发生反应的化学方程式为___________。
(5)下列能说明氯元素原子得电子能力比硫元素原子得电子能力强的是___________。
① HCl的稳定性比H2S的强,② Cl2能与H2S反应生成S,③HCl的溶解度比H2S的大,④还原性:Cl-<S2-,⑤HClO4的酸性比H2SO4的强,⑥HCl的酸性比H2S的强,⑦Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
【答案】第2周期第VIA族 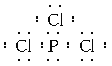 N3->O2->Na+ HClO4 2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑或2Al + 2OH - + 6H2O = 2A(lOH)4- + 3H2↑ Be(OH)2+2NaOH - =Na2BeO2+2H2O ①②④⑤⑦
N3->O2->Na+ HClO4 2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑或2Al + 2OH - + 6H2O = 2A(lOH)4- + 3H2↑ Be(OH)2+2NaOH - =Na2BeO2+2H2O ①②④⑤⑦
【解析】
根据元素在周期表中的位置可知,A为H元素,B为N元素,C为O元素,D为Na元素,E为Mg元素,F为Al元素,G为P元素,H为S元素,I为Cl元素,结合元素周期律分析解答。
(1)上图中元素C为O元素,在周期表中位于第2周期第VIA族;G和I形成的化合物有三氯化磷和五氯化磷等,其中一种物质中各原子最外层均达到8电子稳定结构,该物质为三氯化磷,三氯化磷的电子式为![]() ,故答案为:第2周期第VIA族;
,故答案为:第2周期第VIA族;![]() ;
;
(2)B为N元素,C为O元素,D为Na元素,简单离子的电子层结构相同,电子层数相同的离子,原子序数越大,半径越小,离子半径N3->O2->Na+,上述元素中最高价氧化物对应的水化物中酸性最强的物质为高氯酸,化学式为HClO4,故答案为:N3->O2->Na+;HClO4;
(3)D的最高价氧化物对应的水化物为氢氧化钠,F的单质为铝,二者反应时的离子方程式为2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑或2Al + 2OH - + 6H2O = 2A(lOH)4- + 3H2↑,故答案为:2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑或2Al + 2OH - + 6H2O = 2A(lOH)4- + 3H2↑;
(4)根据周期表对角线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。可选用的试剂为NaOH溶液鉴别Be(OH)2和Mg(OH)2,Be(OH)2能够被NaOH溶解,而Mg(OH)2不能,反应的化学方程式为Be(OH)2+2NaOH - =Na2BeO2+2H2O,故答案为:Be(OH)2+2NaOH - =Na2BeO2+2H2O;
(5)①元素的非金属性越强,对应氢化物的稳定性越强,氯化氢比硫化氢稳定,可说明氯元素的非金属性比硫元素强,能说明氯元素原子得电子能力比硫强,故正确;
②元素的非金属性越强,对应单质的氧化性越强,氯气与H2S能发生置换反应,说明氯气的氧化性大于S,元素的非金属性Cl大于S,能说明氯元素原子得电子能力比硫强,故正确;
③物质的溶解性属于物理性质,与元素的非金属性及得电子能力无关,所以HCl的溶解度比H2S大,不能说明氯元素原子得电子能力比硫强,故错误;
④阴离子的还原性越强,对应元素的非金属性越弱,还原性:Cl-<S2-,元素的非金属性Cl大于S,能说明氯元素原子得电子能力比硫强,故正确;
⑤元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,HClO4的酸性比H2SO4的强,说明元素的非金属性Cl大于S,能说明氯元素原子得电子能力比硫强,故正确;
⑥不能根据氢化物的水溶液的酸性强弱比较非金属性,例如HI的酸性比HCl强,但非金属性Cl>I,故错误
⑦单质与同种金属反应生成的产物的价态越高,说明氧化性越强,则非金属性越强,所以Cl2与铁反应生成FeCl3,而S与铁反应生成FeS,说明氯气的氧化性大于S,元素的非金属性Cl大于S,能说明氯元素原子得电子能力比硫强,故正确;
能说明氯元素原子得电子能力比硫元素原子得电子能力强的有①②④⑤⑦,故答案为:①②④⑤⑦。