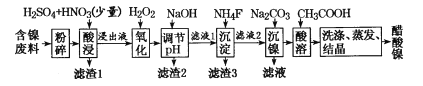
题目内容
【题目】据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可成甘油、医药、农药香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
(1)基态镍原子的价电子排布式为___________________。
(2)1 mol CH2=CH-CH2OH含__________molσ键,烯丙醇分子中碳原子的杂化类型为_____________。
(3)丙醛(CHCH2CHO)的沸点为49℃,丙烯醇(CH2=CHCH2OH)的沸点为91℃,二者相对分子质量相等,沸点相差较大的主要原因是_______________________________。
(4)羰基镍[Ni(CO)4)用于制备高纯度镍粉,它的熔点为-25℃,沸点为43℃。羰基镍晶体类型是_________________。
(5)Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2-和[Ni(SCN)2]-等。NH3的空间构型是_____________,与SCN-互为等电子体的分子为____________。
(6)“NiO”晶胞如图所示。
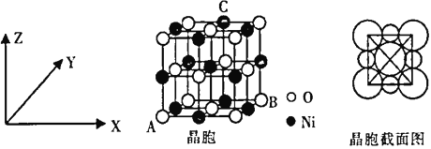
①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C原子坐标参数为____________。
②已知:氧化镍晶胞密度为dg·cm-3,NA代表阿伏加德罗常数的值,则Ni2+半径为__________nm(用代数式表示)。
【答案】 3d84s2 9 sp2、sp3 丙烯醇分子间存在氢键 分子晶体 三角锥形 N2O(或CO2、BeCl2等合理答案) (,1,1) ![]() ×
×![]() ×107
×107
【解析】(1)根据镍是28号元素,结合核外电子的排布规律分析解答;
(2)丙烯醇分子中单键是σ键,双键中有1个σ键;烯丙醇分子中碳原子的杂化类型有2种,饱和碳原子和不饱和碳原子;
(3)根据丙烯醇分子之间存在除范德华力外,还存在氢键分析解答;
(4)根据羰基镍晶体的熔点低分析判断;
(5)根据价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=![]() ×(a-xb)计算NH3中的N原子的价层电子对数,判断N原子的杂化类型,再判断空间构型;根据等电子体的概念分析解答;
×(a-xb)计算NH3中的N原子的价层电子对数,判断N原子的杂化类型,再判断空间构型;根据等电子体的概念分析解答;
(6)①立体坐标系类似平面坐标系,结合A、B两点的原子坐标分析判断;②观察氧化镍晶胞图,1个晶胞含4个“NiO”,面对角线上3个氧离子相切。由密度可以计算晶胞参数a;再计算氧离子半径,最后利用棱上镍离子、氧离子相切求出镍离子半径。
(1)镍是28号元素,基态镍原子的价电子排布式为3d84s2,故答案为:3d84s2;
(2)丙烯醇分子中单键是σ键,双键中有1个σ键,1个是π键,1 mol CH2=CH-CH2OH含9molσ键;烯丙醇分子中碳原子的杂化类型有2种,其中碳碳双键2端的碳原子采用sp2,亚甲基中碳原子采用sp3,故答案为:9;sp2、sp3;
(3)丙醛分子之间存在范德华力,丙烯醇分子之间存在除范德华力外,还存在氢键,氢键比范德华力强,使丙烯醇的沸点比丙醛高,故答案为:丙烯醇分子间存在氢键;
(4)羰基镍晶体的熔点为-25℃,沸点为43℃,熔沸点较低,属于分子晶体,故答案为:分子晶体;
(5)NH3中的N原子的价层电子对数=3+![]() ×(5-3×1)=4,采用sp3杂化,N原子最外层有1个孤电子对,空间构型为三角锥形;SCN-离子的一个电荷提供给碳原子,碳变成N,而O和S的最外层电子数相等,所以,它与N2O互为等电子体,而N2O与CO2也互为等电子体,故答案为:三角锥形;N2O(或CO2、BeCl2等);
×(5-3×1)=4,采用sp3杂化,N原子最外层有1个孤电子对,空间构型为三角锥形;SCN-离子的一个电荷提供给碳原子,碳变成N,而O和S的最外层电子数相等,所以,它与N2O互为等电子体,而N2O与CO2也互为等电子体,故答案为:三角锥形;N2O(或CO2、BeCl2等);
(6)①氧化镍晶胞中原子坐标参数:A(0,0,0)、B(1,1,0),则C点对应的X轴为![]() ,Y轴为1,Z轴为1,原子坐标参数为(
,Y轴为1,Z轴为1,原子坐标参数为(![]() ,1,1),故答案为:(
,1,1),故答案为:(![]() ,1,1);
,1,1);
②设晶胞参数为a,观察氧化镍晶胞图,1个晶胞含4个“NiO”,面对角线上3个氧离子相切,d=![]() ,a=
,a=![]() ×107 nm。因为棱上镍离子、氧离子相切。设氧离子半径为r,有:4r=
×107 nm。因为棱上镍离子、氧离子相切。设氧离子半径为r,有:4r=![]() a,得:r=
a,得:r=![]() a。设镍离子半径为x,有:2r+2x=a,x=
a。设镍离子半径为x,有:2r+2x=a,x=![]() ×
×![]() ×107 nm。
×107 nm。

【题目】2018年5月9日科技网报道,最新一期国际学术期刊《自然·纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇。
(1)甲醇燃烧时发生如下反应(a、b、c、d均大于0):
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) △H1=-akJ·mol-1
②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1) △H2=-bkJ·mol-1
③CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1) △H3=-ckJ·mol-1
④CH3OH(1)+O22(g)=CO (g)+2H2O(1) △H4=-dkJ·mol-1
由此知,a、b、c、d由小到大排序为_______。
(2)工业上,通常采用氢气还原CO2法制备甲醇CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(1) △H
CH3OH(g)+H2O(1) △H
已知几种化学键的键能数据如下:
共价键 | C=O | H-H | C-O | C-H | H-O |
键能/kJ·mol-1 | 803 | 436 | 326 | 414 | 464 |
根据键能数据估算上述反应中△H=____________kJ·mol-1。
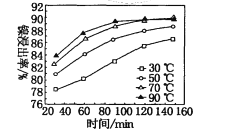
(3)在2L恒容密闭容器中充入2 mol CO2和6.5mlH2,在一定温度下反应,测得混合气体中c(CH3OH)与时间的关系如图1所示。

①M点CO2的正反应速率___________N点CO2的逆反应速率(选填“大于”“小于”或“等于”)。
②0~10min内H2的平均反应速率v(H2)=___________mol·L-1·min-1。
③在该温度下,该反应平衡常数K为________。(结果保留两位小数并要求带单位)
(4)在密闭容器中充入一定量CO2和H2,在含铂催化剂作用下反应,测得单位时间内CO2的转化率与温度关系如图2所示。
①R点对应的CO2转化率最大,其原因是_________________。
②在Q点时CO2的转化率突变的原因可能是_________________。
(5)以石墨为电极,甲醇/空气碱性(KOH溶液为电解质溶液)燃料电池的能量转化效率高。当KOH恰好完全转化成KHCO3时停止放电,此时负极的电极反应式为_____________。