题目内容
3.配制200ml0.1mol/L稀硫酸溶液时,下列实验操作使得所配溶液浓度偏小的是( )| A. | 定容后摇匀,发现液面最低点低于刻度线,再补加几滴蒸馏水至刻度线 | |
| B. | 用量筒量取所需的浓硫酸时仰视读数 | |
| C. | 定容时,俯视刻度线 | |
| D. | 用量筒量取浓硫酸倒入烧杯,再用蒸馏水洗量筒2~3次,洗液倒入烧杯中 |
分析 根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:A、定容后摇匀,发现液面最低点低于刻度线是正常的,再补加几滴蒸馏水至刻度线会导致浓度偏低,故A正确;
B、用量筒量取浓硫酸时仰视读数,则会导致浓硫酸的体积偏大,则所配溶液的浓度偏高,故B错误;
C、定容时俯视刻度线,则溶液的体积偏小,浓度偏高,故C错误;
D、量筒量取完浓硫酸后,量筒的洗涤液应倒入废液缸,如果也倒入烧杯,会导致硫酸的量偏大,则溶液的浓度偏高,故D错误.
故选A.
点评 本题考查了一定物质的量浓度溶液的配制过程中的误差分析,属于基础型题目,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列有机物中,能发生氧化反应、酯化反应和消去反应的是( )
| A. | CH3-CH2OH | B. | CH3COOH | C. | HCHO | D. | CH3COOC2H5 |
11.人体生命活动需要微量元素的参与,贫血是缺少下列哪种微量元素( )
| A. | 碘 | B. | 锌 | C. | 铁 | D. | 铜 |
15.按照下表左边的实验操作,可以观察到表中右边的实验现象.请从“实验现象”栏中选择正确选项的字母代号填入对应的空格中.
| 实验操作 | 答案 | 实验现象 |
| (1)将浓硫酸滴在小木条上 | A.产生白烟 B.产生蓝色物质 C.溶液呈红色 D.变黑色 | |
| (2)将分别蘸浓氨水和浓盐酸的玻璃棒靠近 | ||
| (3)在盛有KI淀粉溶液的试管中滴加氯水 | ||
| (4)在盛有FeC13溶液的试管中滴入2滴KSCN溶液 |
12.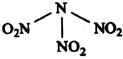 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
 科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )| A. | 该物质既有氧化性又有还原性 | |
| B. | 分子中四个氮原子共平面 | |
| C. | 分子中N、O间形成的共价键是非极性键 | |
| D. | 15.2g该物质含有6.02×1022个原子 |
 .
. 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: