题目内容
A、B、C、D、E是中学化学中五种常见元素,有关信息如下:| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)A的氢化物分子的电子式是______,其水溶液能使酚酞变红的原因用电离方程式解释为:______.
(2)A、D的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法是:______,证明存在该阳离子.
(3)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,则B、C组成的该化合物所含有的化学键为______.
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有:______.
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
(5)E制品通常在潮湿空气中发生电化学腐蚀,该过程的正极反应式为______.
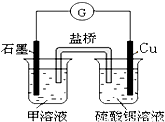
(6)若在D与E组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图所示,其反应中正极出现的现象是______,负极的反应式为:______.
【答案】分析:A最高价氧化物对应的水化物与其氢化物反应生成离子化合物,应为N元素,B为地壳中含量最多的元素,应为O元素,C单质须保存在煤油中,应为Na,D单质与NaOH溶液反应可用于生产漂白液,应为Cl元素,E单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏,应为Fe,结合对应物质的性质以及题目要求解答该题.
解答:解:A最高价氧化物对应的水化物与其氢化物反应生成离子化合物,应为N元素,B为地壳中含量最多的元素,应为O元素,C单质须保存在煤油中,应为Na,D单质与NaOH溶液反应可用于生产漂白液,应为Cl元素,E单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏,应为Fe,
(1)A的氢化物为NH3,电子式为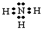 ,对应的水溶液呈碱性:NH3?H2O
,对应的水溶液呈碱性:NH3?H2O  NH4++OH-,故答案为:
NH4++OH-,故答案为: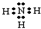 ; NH3?H2O
; NH3?H2O  NH4++OH-;
NH4++OH-;
(2)A、D的氢化物分别为 NH3、HCl,相互反应,产生白色固体,对该固体中阳离子为NH4+,可与碱反应生成碱性气体NH3,用湿润的红色石蕊试纸接近试管口检验放出的气体,试纸变蓝,与浓盐酸反应生成白烟,
故答案为:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生);
(3)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,该化合物为Na2O2,含有离子键和共价键,
故答案为:离子键和共价键;
(4)A与B可组成质量比为7:16的三原子分子,应为NO2,可导致酸雨和光化学烟雾,故答案为:①③;
(5)铁制品通常在潮湿空气中发生电化学腐蚀,正极反应为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(6)若在D与E组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,应为FeCl3,设计成原电池正极反应为2Fe3++2e-=2Fe2+,黄色溶液慢慢变为浅绿色,负极反应为Cu-2e-=Cu2+,
故答案为:黄色溶液慢慢变为浅绿色;Cu-2e-=Cu2+.
点评:本题考查无机物的推断,题目难度不大,注意根据物质的性质推断元素的种类,把握反应原理和应用.
解答:解:A最高价氧化物对应的水化物与其氢化物反应生成离子化合物,应为N元素,B为地壳中含量最多的元素,应为O元素,C单质须保存在煤油中,应为Na,D单质与NaOH溶液反应可用于生产漂白液,应为Cl元素,E单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏,应为Fe,
(1)A的氢化物为NH3,电子式为
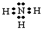 ,对应的水溶液呈碱性:NH3?H2O
,对应的水溶液呈碱性:NH3?H2O  NH4++OH-,故答案为:
NH4++OH-,故答案为: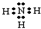 ; NH3?H2O
; NH3?H2O  NH4++OH-;
NH4++OH-;(2)A、D的氢化物分别为 NH3、HCl,相互反应,产生白色固体,对该固体中阳离子为NH4+,可与碱反应生成碱性气体NH3,用湿润的红色石蕊试纸接近试管口检验放出的气体,试纸变蓝,与浓盐酸反应生成白烟,
故答案为:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生);
(3)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,该化合物为Na2O2,含有离子键和共价键,
故答案为:离子键和共价键;
(4)A与B可组成质量比为7:16的三原子分子,应为NO2,可导致酸雨和光化学烟雾,故答案为:①③;
(5)铁制品通常在潮湿空气中发生电化学腐蚀,正极反应为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(6)若在D与E组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,应为FeCl3,设计成原电池正极反应为2Fe3++2e-=2Fe2+,黄色溶液慢慢变为浅绿色,负极反应为Cu-2e-=Cu2+,
故答案为:黄色溶液慢慢变为浅绿色;Cu-2e-=Cu2+.
点评:本题考查无机物的推断,题目难度不大,注意根据物质的性质推断元素的种类,把握反应原理和应用.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水.下列说法不正确的是( )
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |

 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
