题目内容
【题目】实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题.
(1)请写出该实验的实验步骤
①溶解 ②冷却 ③转移 ④⑤⑥摇匀
(2)现在已有下列仪器:托盘天平,烧杯,量筒,要完成本实验还需仪器为:、 .
(3)试分析下列操作对所配溶液的浓度有何影响(偏高、偏低或者无影响)及造成该影响的原因.
①容量瓶用蒸馏洗涤后残留有少量的水,对所配溶液浓度的影响 , 原因是:
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度.对所配溶液浓度的影响 , 原因是: .
【答案】
(1)洗涤;定容
(2)500mL容量瓶;玻璃棒、胶头滴管
(3)无影响;配制完成前,有蒸馏水不会影响溶液的体积,根据公式c= ![]() ,题目中物质的量n不变,溶液体积V无影响,溶液物质的量浓度c无影响;浓度偏小;实际加入溶液的体积偏大,根据公式C=
,题目中物质的量n不变,溶液体积V无影响,溶液物质的量浓度c无影响;浓度偏小;实际加入溶液的体积偏大,根据公式C= ![]() ,当溶质物质的量n不变时,溶液体积V越大,溶液物质的量浓度C就越小
,当溶质物质的量n不变时,溶液体积V越大,溶液物质的量浓度C就越小
【解析】解:(1)配制一定物质的量浓度溶液一般步骤:计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀等,所以答案是:洗涤;定容;(2)用固体配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、烧杯,量筒、500mL容量瓶、玻璃棒、胶头滴管,所以还缺少的仪器:500ml容量瓶、玻璃棒、胶头滴管;
所以答案是:500ml容量瓶、玻璃棒、胶头滴管;(3)①配制完成前,有蒸馏水不会影响溶液的体积,根据公式根据c= ![]() ,题目中物质的量n不变,溶液体积V无影响,溶液物质的量浓度c无影响;
,题目中物质的量n不变,溶液体积V无影响,溶液物质的量浓度c无影响;
所以答案是:无影响;配制完成前,有蒸馏水不会影响溶液的体积,根据公式c= ![]() ,题目中物质的量n不变,溶液体积V无影响,溶液物质的量浓度c无影响;②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,导致溶液体积偏大,根据公式C=
,题目中物质的量n不变,溶液体积V无影响,溶液物质的量浓度c无影响;②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,导致溶液体积偏大,根据公式C= ![]() ,当溶质物质的量n不变时,溶液体积V越大,溶液物质的量浓度C就越小;
,当溶质物质的量n不变时,溶液体积V越大,溶液物质的量浓度C就越小;
所以答案是:浓度偏小;实际加入溶液的体积偏大,根据公式C= ![]() ,当溶质物质的量n不变时,溶液体积V越大,溶液物质的量浓度C就越小.
,当溶质物质的量n不变时,溶液体积V越大,溶液物质的量浓度C就越小.
【考点精析】掌握配制一定物质的量浓度的溶液是解答本题的根本,需要知道配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.

 阳光课堂课时优化作业系列答案
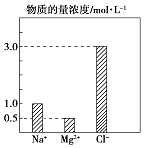
阳光课堂课时优化作业系列答案【题目】某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42﹣、CO32﹣ .
(1)为了进一步确认,对该溶液进行实验检测:
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 仔细观察坐标图 | 肯定无 | 肯定无该离子的理由 |
步骤二 | 该溶液呈无色、透明、均一状态 | 肯定无 | 肯定无该离子的理由 |
步骤三 | 加入足量BaCl2溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失 | 肯定有SO42﹣、H+;肯定无Ba2+ | 肯定有H+的理由 |
实验操作的步骤三中称量沉淀前的实验操作步骤有:过滤、、灼烧、在干燥器中冷却.
(2)原溶液中H+物质的量浓度为mol/L.
(3)向溶液中加入NaHCO3溶液,反应的离子方程式为: .
(4)若向 100mL 该溶液中加入 1mol/L 的 Ba(OH)2溶液,恰好沉淀完全时加入的Ba(OH)2溶液体积为 L.