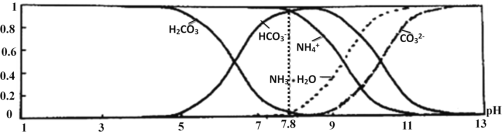
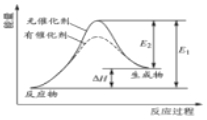
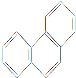
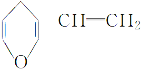题目内容
【题目】原子序数依次增大的五种短周期主族元素X、Y、Z、P、Q分别位于三个周期,X与Z、Y与P分别位于同主族,Z与Y可形成原子个数比分别为1∶1和2∶1的离子化合物。则下列说法正确的是![]()
A. 简单氢化物的沸点:Q>Y
B. 简单氢化物的热稳定性:Y>Q>P
C. 非金属性强弱:Q>P>Y>X
D. X、Y、Z、P形成的化合物的水溶液显碱性
【答案】B
【解析】
原子序数依次增大的五种短周期主族元素X、Y、Z、P、Q分别位于三个周期,Z与Y可形成原子个数比分别为1∶1和2∶1的离子化合物,为Na2O、Na2O2两种常见的离子化合物,则Y为O,Z为Na,X与Z、Y与P分别位于同主族,则X为H,P为S,Q只能为Cl,据此分析解答。
由上述分析可知,X为H,Y为O,Z为Na,P为S,Q为Cl。
A.水分子间能够形成氢键,沸点高于氯化氢,故A错误;
B.非金属性Y>Q>P ,简单氢化物的热稳定性:Y>Q>P ,故B正确;
C.同一周期,从左向右,非金属性增强,同一主族,从上到下,非金属性减弱,非金属性:Y>Q,故C错误;
D.X、Y、Z、P形成的化合物为硫酸氢钠或亚硫酸氢钠,均电离显酸性,故D错误;
答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】(1)氨气还原氮氧化物的反应为:
①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=___。(用含△H1、△H2的式子表示)
依据反应②,将氨气设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____。
(2)一定温度下,向2L恒容密闭容器中充4.0molNO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)N2(g)+4CO2(g) △H<0,测得相关数据如表:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/molL1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/molL1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①05min,用NO2的浓度变化表示的反应速率为______。
②以下表述能说明该反应己达到平衡状态的是_____。
A.2v(NO2)正=v(N2)逆 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.N2与CO2的物质的量之比保持不变
③20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,反应再次达到平衡时,NO2的转化率比原平衡___(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K=____。
(3)湿法脱硝:采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如表:
离子 | NO3 | NO2 | Cl |
c/(molL1) | 2.0×104 | 1.0×104 | 1.75×104 |
①NaClO2溶液显碱性,用离子方程式解释原因_____。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式_____