题目内容
8.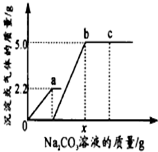 向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10%的Na2CO3溶液,反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示.下列说法正确的是( )
向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10%的Na2CO3溶液,反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示.下列说法正确的是( )| A. | 图中oa段表示生成沉淀的过程 | B. | b点溶液中溶质有2种 | ||
| C. | c点溶液的pH=7 | D. | x值为106.0 |
分析 加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了.
解答 解:A、图中oa段表示生成的气体质量,故A错误;
B、b点表示碳酸钠恰好完全反应,溶液中只含有NaCl一种溶质,故B错误;
C、c点的溶液中含有Na2CO3、NaCl两种溶质,由于Na2CO3显碱性,NaCl显中性,所以c的溶液的pH>7,故C错误;
D、根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知碳酸钠与盐酸反应生成气体2.2g,碳酸钠与氯化钙反应,生成沉淀5.0g.设生成2.2g气体所需的Na2CO3的质量为y,生成沉淀5.0g所需Na2CO3的质量为z.则
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
y 2.2g
$\frac{106}{y}=\frac{44}{2.2g}$解得,y=5.3g;
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
z 5.0g
$\frac{106}{z}$=$\frac{100}{5.0g}$,解得z=5.3g;
所以x=$\frac{5.3g+5.3g}{10%}$=106.0g,故D正确.
故选D.
点评 解答本题关键要知道只有把盐酸反应完了,才能与氯化钙反应产生沉淀,因为如果碳酸钠与氯化钙先反应生成了碳酸钙沉淀,也会被剩余的盐酸溶解掉,将不会看到沉淀.

练习册系列答案
相关题目
3.下列叙述中,不能用勒夏特列原理解释的是( )
| A. | 向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色 | |
| B. | 高压比常压有利于SO2与O2合成SO3的反应 | |
| C. | 工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 | |
| D. | 对CO(g)+NO2(g)?CO2(g)+NO(g),平衡体系增大压强可使颜色变深 |
13.向Fe(OH)3 胶体中逐滴加入一种液体,先发生凝聚而沉淀,继续加入则沉淀消失,这种溶液是( )
| A. | 蒸馏水 | B. | 0.5 mol•L-1 H2SO4 | ||
| C. | 蔗糖溶液 | D. | 0.5 mol•L-1MgSO4 溶液 |
20.下列物质中,分子数目最多的是( )
| A. | 1g H2 | B. | 3.01×1023个N2 | ||
| C. | 0.75 mol Cl2 | D. | 标准状况下4.48 L O2 |
17.下列元素中,位于周期表第ⅥA族的元素是( )
| A. | Mg | B. | Na | C. | S | D. | P |