题目内容
3.下列叙述中,不能用勒夏特列原理解释的是( )| A. | 向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色 | |
| B. | 高压比常压有利于SO2与O2合成SO3的反应 | |
| C. | 工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 | |
| D. | 对CO(g)+NO2(g)?CO2(g)+NO(g),平衡体系增大压强可使颜色变深 |
分析 平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释.
解答 解:A.向橙色K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色,发生Cr2O72-+H2O?2CrO42-+2H+,平衡向正反应方向移动,能用平衡移动原理解释,故A不选;
B.存在平衡2SO2+O2(g)?2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3,能用平衡移动原理解释,故B不选;
C.反应为可逆反应,使K变成蒸气从反应混合物中分离出来,生成物浓度减小,平衡向正向移动,能用平衡移动原理解释,故C不选;
D.增大压强导致体积减小,所以二氧化氮浓度增大,气体颜色加深,但不影响平衡移动,所以不能用平衡移动原理解释,故D选;
故选D.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.

练习册系列答案
相关题目
11.用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A. | 含有0.5NA个氢原子的水的质量为4.5g | |
| B. | 117gNaCl晶体中含有2NA个Na+ | |
| C. | 25℃101kPa时,22.4LCO2和CO的混合气体所含的分子数约为NA | |
| D. | 含有23g钠离子的溶液1L,则Na+含有电子数约为10NA |
18.下列各组离子在指定的条件下能大量共存的是( )
| A. | 在酸性溶液中:Ba2+、K+、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 在无色溶液中:Na+、K+、MnO4-、NO${\;}_{3}^{-}$ | |
| C. | 在含有大量Al3+的溶液中:K+、Na+、NH4+、SO${\;}_{4}^{2-}$ | |
| D. | 在使甲基橙变黄的溶液中:Na+、I-、ClO-、OH- |
8.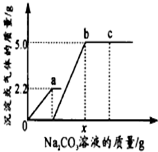 向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10%的Na2CO3溶液,反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示.下列说法正确的是( )
向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10%的Na2CO3溶液,反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示.下列说法正确的是( )
 向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10%的Na2CO3溶液,反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示.下列说法正确的是( )
向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10%的Na2CO3溶液,反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示.下列说法正确的是( )| A. | 图中oa段表示生成沉淀的过程 | B. | b点溶液中溶质有2种 | ||
| C. | c点溶液的pH=7 | D. | x值为106.0 |
15.密度为d g•cm-3的溶液V mL含有摩尔质量为M g•mol-1的溶质m g,其物质的量浓度为c mol•L-1,质量分数为w%,下列表示式不正确的是( )
| A. | c=$\frac{1000m}{VM}$ | B. | m=$\frac{dVw}{100}$ | C. | d=$\frac{cM}{10w}$ | D. | w%=$\frac{cM}{1000d}$% |
13.将下列离子方程式改写成相应的化学方程式,正确的是( )
| A. | Cu2++2OH-═Cu(OH)2↓; CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O; BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓; Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-═H2O; 2KOH+H2SO4═K2SO4+2H2O |
 ;Al粉可以与许多金属氧化物配成铝热剂,写出Al与Fe2O3反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
;Al粉可以与许多金属氧化物配成铝热剂,写出Al与Fe2O3反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.