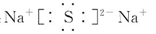题目内容
已知:①Na3N+3H2O=3NaOH+NH3↑,②NaH+H2O=NaOH+H2↑。下列叙述正确的是
| A.离子半径:Na+>N3->H+ |
| B.反应①和②都是氧化还原反应 |
| C.反应②每生成1 mol H2,转移的电子数为NA |
| D.Na3N和NaH与盐酸反应都只生成一种盐 |
C
试题分析:A、离子的核外电子层数越多离子半径越大。在核外电子排布相同的条件下原子序数越大,离子半径越小,则.离子半径:N3->Na+>H+,A不正确;B、有元素化合价发生变化的反应是氧化还原反应,在反应①中元素的化合价均不变化,不是氧化还原反应。反应②中氢元素的化合价发生变化,属于氧化还原反应,B不正确;C、反应②中氢元素的化合价分别从NaH中-1价和水中+1价变化到0价,注意1个电子,所以反应②每生成1 mol H2,转移的电子数为NA,C正确;D、根据反应①可知Na3N与盐酸反应生成氯化钠和氯化铵两种盐,D不正确,答案选C。

练习册系列答案
相关题目
 Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )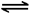 CO2(g)+H2(g) △H=-41kJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0molH2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为 ,由此可知在该温度下反应CO2(g)+H2(g)
CO2(g)+H2(g) △H=-41kJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0molH2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为 ,由此可知在该温度下反应CO2(g)+H2(g)