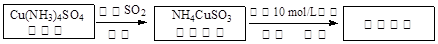题目内容
超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下:
试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有______.(填字母序号)
A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子
C.[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氧元素
D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体
(2)NH4CuSO3中的金属阳离子的核外电子排布式为:______.
(3)SO
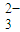 离子中S硫原子的杂化方式为______,与其互为等电子体的一种分子的分子式是______.
离子中S硫原子的杂化方式为______,与其互为等电子体的一种分子的分子式是______.(4)NH3易液化的原因是______.
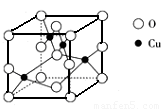
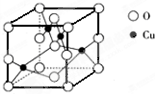
(5)如图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式为______.
(6)NH4CuSO3与硫酸微热时除得到超细铜粉外,还可看到溶液变蓝,同时有使品红褪色的气体.则该反应的离子方程式为______ 2NH4++Cu2++Cu+2SO2↑+2H2O

【答案】分析:(1)A.阴阳离子存在离子键,非金属元素间易形成共价键,配合物中存在配位键;
B.NH3为配体分子,溶液中不存在NH3;
C.根据第一电离能的变化规律比较其大小;
D.根据价层电子对互斥理论判断离子构型.
(2)NH4CuSO3中Cu的化合价为+1价,结合Cu的原子核外电子排布书写;
(3)SO32-中含有3个δ键和1个孤电子对,结合等电子体的定义判断;
(4)NH3分子间可形成氢键,易液化;
(5)利用均摊法计算;
(6)除得到超细铜粉外,还可看到溶液变蓝,同时有使品红褪色的气体,说明生成Cu、Cu2+和SO2.
解答:解:(1)A.[Cu(NH3)4]SO4中硫酸根离子和[Cu(NH3)4]2+存在离子键,N原子和铜原子之间存在配位键,NH3中H和N之间存在共价键,所以[Cu(NH3)4]SO4中所含的化学键有共价键、离子键、配位键,故A正确;
B.NH3为配体分子,溶液中不存在NH3,故B错误;
C..元素周期律中,同一周期元素的第一电离能随着原子序数的增大而增大,但N原子最外层达到半饱和的稳定结构,难以失去电子,所以其第一电离能大小为N>O,故C错误
D.SO42-离子中价层电子对数为4+ ×(6+2-4×2)=4,孤电子对数为0,所以是正四面体体型,故D正确.
×(6+2-4×2)=4,孤电子对数为0,所以是正四面体体型,故D正确.
故答案为:AD.
(2)Cu原子的核外电子排布式为[Ar]3d104s1,NH4CuSO3中Cu的化合价为+1价,则金属阳离子的核外电子排布式为
[Ar]3d10,故答案为[Ar]3d10:
(3)SO32-中含有3个δ键和1个孤电子对,故为sp3杂化,离子含有4的原子,价电子总数为26,对应的等电子体有NF3(或PF3、NCl3、PCl3等),故答案为:sp3;NF3(或PF3、NCl3、PCl3等);
(4)N元素的非金属性较强,对应的氢化物中含有氢键,沸点较高,易液化,故答案为:NH3分子间可形成氢键,
(5)晶胞中4个Cu位于晶胞内部,O位于晶胞的顶点和面心,共有8× +6
+6 =4,则该氧化物的化学式为CuO,
=4,则该氧化物的化学式为CuO,
故答案为:CuO;
(6)除得到超细铜粉外,还可看到溶液变蓝,同时有使品红褪色的气体,说明生成Cu、Cu2+和SO2,反应的离子方程式为2NH4CuSO3 +4H+ 2NH4++Cu2++Cu+2SO2↑+2H2O,
2NH4++Cu2++Cu+2SO2↑+2H2O,
故答案为:2NH4CuSO3 +4H+ 2NH4++Cu2++Cu+2SO2↑+2H2O.
2NH4++Cu2++Cu+2SO2↑+2H2O.
点评:本题较为综合,突出考查配合物知识、核外电子排布、杂化类型、等电子体、氢键、晶胞的计算等问题,综合性较强,全面考查物质的结构和性质,题目难度较大.
B.NH3为配体分子,溶液中不存在NH3;
C.根据第一电离能的变化规律比较其大小;
D.根据价层电子对互斥理论判断离子构型.
(2)NH4CuSO3中Cu的化合价为+1价,结合Cu的原子核外电子排布书写;
(3)SO32-中含有3个δ键和1个孤电子对,结合等电子体的定义判断;
(4)NH3分子间可形成氢键,易液化;
(5)利用均摊法计算;
(6)除得到超细铜粉外,还可看到溶液变蓝,同时有使品红褪色的气体,说明生成Cu、Cu2+和SO2.
解答:解:(1)A.[Cu(NH3)4]SO4中硫酸根离子和[Cu(NH3)4]2+存在离子键,N原子和铜原子之间存在配位键,NH3中H和N之间存在共价键,所以[Cu(NH3)4]SO4中所含的化学键有共价键、离子键、配位键,故A正确;
B.NH3为配体分子,溶液中不存在NH3,故B错误;
C..元素周期律中,同一周期元素的第一电离能随着原子序数的增大而增大,但N原子最外层达到半饱和的稳定结构,难以失去电子,所以其第一电离能大小为N>O,故C错误
D.SO42-离子中价层电子对数为4+
 ×(6+2-4×2)=4,孤电子对数为0,所以是正四面体体型,故D正确.
×(6+2-4×2)=4,孤电子对数为0,所以是正四面体体型,故D正确.故答案为:AD.
(2)Cu原子的核外电子排布式为[Ar]3d104s1,NH4CuSO3中Cu的化合价为+1价,则金属阳离子的核外电子排布式为
[Ar]3d10,故答案为[Ar]3d10:
(3)SO32-中含有3个δ键和1个孤电子对,故为sp3杂化,离子含有4的原子,价电子总数为26,对应的等电子体有NF3(或PF3、NCl3、PCl3等),故答案为:sp3;NF3(或PF3、NCl3、PCl3等);
(4)N元素的非金属性较强,对应的氢化物中含有氢键,沸点较高,易液化,故答案为:NH3分子间可形成氢键,
(5)晶胞中4个Cu位于晶胞内部,O位于晶胞的顶点和面心,共有8×
 +6
+6 =4,则该氧化物的化学式为CuO,
=4,则该氧化物的化学式为CuO,故答案为:CuO;
(6)除得到超细铜粉外,还可看到溶液变蓝,同时有使品红褪色的气体,说明生成Cu、Cu2+和SO2,反应的离子方程式为2NH4CuSO3 +4H+
 2NH4++Cu2++Cu+2SO2↑+2H2O,
2NH4++Cu2++Cu+2SO2↑+2H2O,故答案为:2NH4CuSO3 +4H+
 2NH4++Cu2++Cu+2SO2↑+2H2O.
2NH4++Cu2++Cu+2SO2↑+2H2O.点评:本题较为综合,突出考查配合物知识、核外电子排布、杂化类型、等电子体、氢键、晶胞的计算等问题,综合性较强,全面考查物质的结构和性质,题目难度较大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
(14分)超细铜粉主要应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:
试回答下列问题:
(1)下列关于[Cu(NH3)4]SO4的说法中,正确的有__________。(填字母序号)
| A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子 |
| C.[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氧元素 |
| D.[Cu(NH3)4]SO4的外界离子的空间构型为正四面体 |
(3)SO2–3 离子中S硫原子的杂化方式为________,与其互为等电子体的一种分子的分子式是___________。
(4)NH3易液化的原因是___________________。
(5)右图是铜的某种氧化物的晶胞结构示意图,由此可确定该氧化物的化学式为__
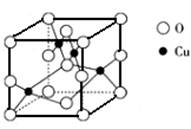 ___________。
___________。(6)NH4CuSO3与硫酸微热反应的离子方程式为__________________________。
 超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下:
超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某制备方法如下: