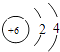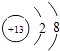��Ŀ����
����Ŀ��ij�¶�ʱ����һ��10L�ĺ��������У�X��Y��Z��Ϊ���壬�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ��������գ� 
��1���÷�Ӧ�Ļ�ѧ����ʽΪ��
��2����Ӧ��ʼ��2min��������Z��ʾ��ƽ����Ӧ����Ϊ��
��3��ƽ��ʱ�����ڻ�������ܶȱ���ʼʱ�������С������ȡ���ͬ������������ƽ����Է�����������ʼʱ��
��4����a mol X��b mol Y�Ļ�����巢��������Ӧ����Ӧ��ijʱ�̸����ʵ���ǡ�����㣺n��X��=n��Y��=2n��Z������ԭ���������a��b= ��
���𰸡�
��1��3X+Y?2Z
��2��0.01mol/��L?min��
��3����ȣ���
��4��7��5
���������⣺��1������ͼʾ������֪����X��Y�Ƿ�Ӧ�X��Y��Z�ı仯��֮����0.3��0.1��0.2=3��1��2����Ӧ�Ļ�ѧ����ʽΪ��3X+Y2Z�����Դ��ǣ�3X+Y2Z����2����Ӧ��ʼ��2min��������Z��ʾ��ƽ����Ӧ����v= ![]() =0.01 mol/��Lmin�������Դ��ǣ�0.01 mol/��Lmin������3����������ܶȦ�=
=0.01 mol/��Lmin�������Դ��ǣ�0.01 mol/��Lmin������3����������ܶȦ�= ![]() ���ӿ�ʼ��ƽ�⣬�������غ�ģ�����Dz���ģ������ܶ�ʼ�ղ��䣬��������ƽ����Է�������M=
���ӿ�ʼ��ƽ�⣬�������غ�ģ�����Dz���ģ������ܶ�ʼ�ղ��䣬��������ƽ����Է�������M= ![]() ���ӿ�ʼ��ƽ�⣬�������غ�ģ�����n����С�ģ�����M�������Դ��ǣ���ȣ���4��3X+Y2Z����Y�ı仯����x����ʼ����a b 0�仯����3x x 2xƽ������a��3x b��x 2x��n ��X��=n ��Y��=2n ��Z��ʱ��a��3x=b��x=4x����a=7x��b=5x������ԭ���������a��b=7��5�����Դ��ǣ�7��5��
���ӿ�ʼ��ƽ�⣬�������غ�ģ�����n����С�ģ�����M�������Դ��ǣ���ȣ���4��3X+Y2Z����Y�ı仯����x����ʼ����a b 0�仯����3x x 2xƽ������a��3x b��x 2x��n ��X��=n ��Y��=2n ��Z��ʱ��a��3x=b��x=4x����a=7x��b=5x������ԭ���������a��b=7��5�����Դ��ǣ�7��5��

 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬ʵ����������۾���ȷ����(����)

ѡ�� | ʵ���Լ� | ʵ������ | ʵ����� | ||
a | b | c | |||
A | Ũ��ˮ | ��ʯ�� | FeCl2��Һ | ������ɫ������Ѹ�ٱ�Ϊ����ɫ������Ϊ���ɫ | �������������� |
B | ϡ���� | FeS | AgCl����Һ | ����Һ�ɰ�ɫ��Ϊ��ɫ | Ksp(AgCl)>Ksp(Ag2S) |
C | Ũ���� | ͭ | BaSO3����Һ | ����Һ����� | +4������л�ԭ�� |
D | Ũ���� | KMnO4 | ��ɫʯ����Һ | ��Һ�ȱ�����ɫ | Cl2�����Ժ�Ư���� |
A. A B. B C. C D. D
����Ŀ���������ҹ���Ҫ��ú̿�������أ�ͨ��ú��������Һ������ʹú̿���Ը��㷺��Ӧ�á�
I����ҵ���Ƚ�úת��ΪCO��������CO��ˮ������Ӧ��H2ʱ����������ƽ�⣺
CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
��1����2L�����ܱ������г���CO��H2O��g����800��ʱ��ò����������±���
t/min | 0 | 1 | 2 | 3 | 4 |
n��H2O��/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
n��CO��/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
��ӷ�Ӧ��ʼ��2minʱ����H2��ʾ�ķ�Ӧ����Ϊ_________________�����¶��·�Ӧ��ƽ�ⳣ��K=___________________��С�������1λ��Ч���֣���
��2����ͬ�����£���2L�����ܱ������г���1molCO��3mol H2O��g����2molCO2��g����2mo1 H2��g������ʱv��________v�����>�� ��<�� �� ��=������
��.һ����������CO��H2�ϳ�CH3OH��CO��g��+2H2��g��CH3OH��g����H=��105kJmol��1�������Ϊ2L���ܱ������г���2mol CO��4mol H2����ò�ͬ�¶��������ڵ�ѹǿ��P��kPa����ʱ�䣨min���ı仯��ϵ����ͼ�Т�������ʾ��
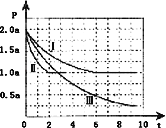
��1����͢���ȣ��ı�ķ�Ӧ������______��
��2����Ӧ����6minʱ�ﵽƽ�⣬�ڴ������´ӷ�Ӧ��ʼ���ﵽƽ��ʱv��CH3OH��=______��
��3����Ӧ����2minʱ�ﵽƽ�⣬ƽ�ⳣ��K������=______��
��4���ȽϷ�Ӧ����¶ȣ�T1���ͷ�Ӧ����¶ȣ�T3���ĸߵͣ�T1_____T3���������������=�������жϵ�������_________________________________________________________��