题目内容
将一定量的CH4在O2中点燃,CH4已完全反应,燃烧产物为CO、CO2和H2O(g)。此混合气体的质量为49.6 g,当其缓缓通过足量干燥的CaCl2时,CaCl2增重25.2g。原燃烧产物中CO2的质量为( )A.12.5g B.19.7g C.13.2g D.24.4g
解析:在CO、CO2、H2O中被CaCl2吸收的是H2O,25.2gH2O的物质的量是1.4mol,与之对应的CH4是0.7mol。由0.7 mol CH4燃烧生成的CO和CO2共0.7mol。
CO、CO2的总质量为:49.6g-25.2g=24.4g
设CO、CO2的物质的量分别为x、y。
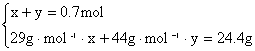
解得x=0.4mol,y=0.3mol
0.3molCO2的质量:0.3mol×44g·mol-1=13.2g。
答案:C

练习册系列答案
相关题目
