题目内容
(1)有机化合物A、B分子式不同,它们只可能含C、H、O元素中的两种或三种。如果将A、B不论以何种比例混合,只要其物质的量之和不变,完全燃烧时消耗O2和生成H2O的物质的量也不变。那么A、B组成必须满足的条件是______________。若A为CH4,则符合上述条件的B中相对分子质量最小的是______________ (写分子式),并写出相对分子质量最小且含甲基的B的两种同分异构体的结构简式______________、______________。
(2)一定量的乙醇在氧气不足时燃烧,得CO2、CO和H2O共27.6 g,若其中水为10.8 g,则CO的质量为______________。
A.1.4 g B.2.2 g C.4.4 g D.2.2 g和4.4 g之间
(1)A、B的分子中含氢原子数相同,且相差n个碳原子时,必相差2n+1个氧原子(n为正整数) C2H4O2 CH3COOH HCOOCH3
(2)A
解析:
以上两题是有机物燃烧的分析和计算。
第(1)小题是有机物完全燃烧,则碳全部转化为CO2。从题中要求符合的条件看,耗CO2量难分析,而生成水的量易分析。总的物质的量一定,A、B分子中含H的个数相同时,生成水的量不变。这样再分析耗O2量,分子中H个数相同。那么根据有机物完全燃烧规律,在物质的量一定时,有机分子中减若干CO2耗O2量不变,则A、B分子中必相差若干个CO2。
后两问则根据上述结论进一步回答。A为CH4,B则加一个CO2(C2H4O2),它是饱和一元脂肪羧酸或酯的组成,可顺利写出答案。
第(2)小题是有机物不完全燃烧,因为生成了两种含碳的物质,写出的化学方程式应有无数组计量数,而根据乙醇中H全部转化为水,可利用水的质量求出乙醇的物质的量。然后再根据碳原子守恒可知CO、CO2物质的量之和,本题可解。解法为:
C2H5OH—3 H2O
![]()
解得:x=0.2 mol
C2H5OH—2COx
0.2 mol 0.4 mol
CO、CO2混合求得![]() =42
=42
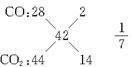
m(CO)=n(CO)×28 g·mol-1=0.4 mol×![]() ×28 g·mol-1=1.4 g
×28 g·mol-1=1.4 g
注意,有机物是否完全燃烧,氢化物全部转化为水。这两个问题抓住这个突破口,使思路展开。另外,题目所给条件较多时,应注意使用条件的顺序。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案




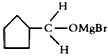 ,该中间产物水解可得C。从有机反应类型看,B生成中间产物
,该中间产物水解可得C。从有机反应类型看,B生成中间产物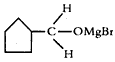 的反应类型属于____________。
的反应类型属于____________。