题目内容
短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数.其中X是形成化合物种类最多的元素.Y固体单质与盐酸反应,再向反应后的溶液中加入一定量的烧碱溶液,最终溶液中有白色沉淀Q生成.Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液.W的最高价氧化物形成的水化物在自然界中酸性最强填写下列空白:
(1)X的最高价氧化物的结构式为
(2)写出生成白色沉淀Q的化学方程式 ,已知298K时,该物质的Ksp=5.6×10-12,若此时测得溶液PH=13.00,则此温度下残留在溶液中的Y离子物质的量浓度为 .
(3)Z元素的氧化物溶于浓NaOH溶液的离子方程式:
(4)写出W单质的一种用途 .
(5)Y、Z、W四种元素的原子半径由大到小的顺序为 (用元素符号表示)
(1)X的最高价氧化物的结构式为
(2)写出生成白色沉淀Q的化学方程式
(3)Z元素的氧化物溶于浓NaOH溶液的离子方程式:
(4)写出W单质的一种用途
(5)Y、Z、W四种元素的原子半径由大到小的顺序为
分析:短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数.其中X是形成化合物种类最多的元素,则X为C元素;Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液,为两性氧化物,则Z为Al;Y固体单质与盐酸反应,再向反应后的溶液中加入一定量的烧碱溶液,最终溶液中有白色沉淀Q生成,则Y为Mg、Q为Mg(OH)2;W的最高价氧化物形成的水化物在自然界中酸性最强,则W为Cl,据此解答.
解答:解:短周期元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数均不少于最内层电子数.其中X是形成化合物种类最多的元素,则X为C元素;Z元素的氧化物既能溶于稀硫酸,又能溶于浓NaOH溶液,为两性氧化物,则Z为Al;Y固体单质与盐酸反应,再向反应后的溶液中加入一定量的烧碱溶液,最终溶液中有白色沉淀Q生成,则Y为Mg、Q为Mg(OH)2;W的最高价氧化物形成的水化物在自然界中酸性最强,则W为Cl,
(1)X的最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对,其结构式为O=C=O,
故答案为:O=C=O;
(2)生成白色沉淀Mg(OH)2的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,
已知298K时,该物质的Ksp=5.6×10-12,若此时测得溶液pH=13.00,则c(OH-)=0.1mol/L,故c(Mg2+)=
mol/L=5.6×10-10 mol/L,
故答案为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;5.6×10-10mol/L;
(3)氧化铝与浓NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)氯气可以制漂白粉或自来水的消毒、药物的合成、农药的生产等,故答案为:制漂白粉或自来水的消毒、药物的合成、农药的生产等;
(5)Mg、Al、Cl同周期,随原子序数增大原子半径减小,故原子半径Mg>Al>Cl,故答案为:Mg>Al>Cl.
(1)X的最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对,其结构式为O=C=O,
故答案为:O=C=O;
(2)生成白色沉淀Mg(OH)2的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,
已知298K时,该物质的Ksp=5.6×10-12,若此时测得溶液pH=13.00,则c(OH-)=0.1mol/L,故c(Mg2+)=
| 5.6×10-12 |
| 0.12 |
故答案为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;5.6×10-10mol/L;
(3)氧化铝与浓NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(4)氯气可以制漂白粉或自来水的消毒、药物的合成、农药的生产等,故答案为:制漂白粉或自来水的消毒、药物的合成、农药的生产等;
(5)Mg、Al、Cl同周期,随原子序数增大原子半径减小,故原子半径Mg>Al>Cl,故答案为:Mg>Al>Cl.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,注意掌握溶度积的应用与有关计算,难度不大.

练习册系列答案
相关题目
碱金属元素可形成离子型氢化物,下表是同一短周期元素X、Y、Z三种元素氢化物的某些性质
则这三种元素的原子序数从大到小的排列顺序为( )
| 元素 | 熔点(℃) | 沸点(℃) | 与水作用 | 纯液体的导电性 |
| X | -183 | -162 | 不与水反应也不溶于水 | 不导电 |
| Y | -102 | 19 | 放热,形成的酸是弱酸 | 不导电 |
| Z | 680 | - | 剧烈反应生成H2,溶液呈碱性 | 导电 |
| A、X、Y、Z |
| B、Z、X、Y |
| C、Y、X、Z |
| D、Z、Y、X |
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法中不正确的是( )
| X | Y | ||||
| Z | M | R | |||
| A、元素X和Y可以形成两种以上的气态化合物 |
| B、原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C、元素的最高价氧化物对应水化物的酸性R强于M |
| D、加热蒸干由元素R和Z形成的化合物的水溶液可以得到该化合物的晶体 |
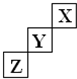 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )