题目内容
【题目】钻蓝(含Co、Al、O三种元素)是一种带绿光的蓝色颜料。固相法是制备钴蓝颜料方法之一,即将钴、铝的氧化物(或是两者的氢氧化物)按一定比例负载于石墨烯上,然后在马弗炉中高温灼烧、冷却、研磨。回答下列问题:
(1)基态钴原子核外电子排布式为[Ar]__。
(2)下列O原子电子排布图表示的状态中,能量最低的是__(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)已知Co的活泼性与Fe相近,Co、Al、O的电负性从大到小的顺序为__。
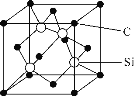
(4)石墨烯的结构如图甲所示。
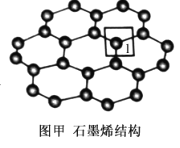
①每个石墨烯分子中,C(如图中1位置处)可形成σ键的个数为__,其杂化类型为___。
②C原子在形成化合物时,其键型以共价键为主,原因是__。
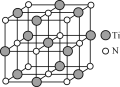
(5)钴蓝晶胞结构如图乙所示,其立方晶胞由4个I型和4个II型小立方体构成。

①钴蓝的化学式为__。
②已知NA为阿伏加德罗常数的值,钴蓝晶体的密度为__g·cm-3(列计算式即可)。
【答案】3d74s2 A O>Co>Al 1.5 sp2 C有四个价电子且半径小,难以通过得失电子达到稳定结构 CoAl2O4 ![]()
【解析】
(1)根据构造原理写出基态钴原子的核外电子排布式;
(2)原子核外电子排布中,电子所占的轨道能级越低,低能级轨道上电子数目越多,该原子能量越低;
(3)一般非金属元素的电负性大于金属元素的电负性,金属性越强,电负性越小;
(4)①利用均摊法计算,根据杂化轨道理论分析C原子的杂化方式;
②根据C原子的价电子排布以及原子结构分析;
(5)①先以I型和II型合起来的长方体为重复单元,计算该重复单元中Co、Al、O原子个数,再计算晶胞内Co、Al、O个数,进而化简为最简整数比,得到化学式;
②先计算该晶胞体积、和晶胞质量,进而计算钴蓝晶体的密度。
(1)钴原子为27号元素,根据构造原理,可写出基态钴原子的核外电子排布式为[Ar]3d74s2,故答案为:3d74s2;
(2)原子核外电子排布中,如果电子所占的轨道能级越低,该原子能量越低,低能级轨道上电子数目越多,该原子能量越低,能级的能量高低顺序是1s<2s<2p,其中核外电子按照构造原理排布时,原子处于基态,能量最低,A项排布是按照构造原理进行的,因此能量最低,故答案为:A;
(3)已知Co的活泼性与Fe相近,则Co的金属性弱于Al,相反,Co的电负性比Al的电负性大,一般非金属元素的电负性大于金属元素的电负性,则三者的电负性从大到小的顺序为O>Co>Al,故答案为:O>Co>Al;
(4)①根据石墨烯的结构图,利用均摊法可知,每个石墨烯分子中,C原子可形成σ键的个数为![]() ,石墨烯是一种由单层碳原子构成的平面结构,碳原子的杂化类型为sp2,故答案为:1.5;sp2;
,石墨烯是一种由单层碳原子构成的平面结构,碳原子的杂化类型为sp2,故答案为:1.5;sp2;
②由于C有四个价电子且半径小,难以通过得失电子达到稳定结构,则C原子在形成化合物时,其键型以共价键为主,故答案为:C有四个价电子且半径小,难以通过得失电子达到稳定结构;
(5)①以I型和II型合起来的长方体为重复单元,该重复单元中Co原子个数=![]() 个,同时含有4个Al和8个O,晶胞内有4个I型和II型合起来的长方体,因而晶胞内总计有8个Co、16个Al和32个O,则Co、Al、O个数比为8:16:32=1:2:4,化学式为CoAl2O4,故答案为:CoAl2O4;
个,同时含有4个Al和8个O,晶胞内有4个I型和II型合起来的长方体,因而晶胞内总计有8个Co、16个Al和32个O,则Co、Al、O个数比为8:16:32=1:2:4,化学式为CoAl2O4,故答案为:CoAl2O4;
②该晶胞体积=(2a×107cm)3,晶胞相当于有8个“CoAl2O4”,故晶胞质量=![]() ,故钴蓝晶体的密度
,故钴蓝晶体的密度![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案