题目内容
8.下列物质的分类合理的是( )| A. | 氧化物:CO、NO2、SO2、H2O | |
| B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| C. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3•H2O | |
| D. | 酸:H2SO4、HNO3、H2CO3、NaHSO4 |
分析 酸是指在电离时产生的阳离子全部是氢离子的化合物;碱是指在电离时产生的阴离子全部是氢氧根离子的化合物,根据提供的元素氢氧化锌等属于碱;氧化物是只含有两种元素且其中一种元素是氧元素的化合物;铵盐是由铵根离子和酸根离子组成的化合物,据此回答.
解答 解:A、氧化物是只含有两种元素且其中一种元素是氧元素的化合物,CO、NO2、SO2、H2O均符合,属于氧化物,故A正确;
B、碱是指在电离时产生的阴离子全部是氢氧根离子的化合物,Na2CO3属于盐,故B错误;
C、铵盐是由铵根离子和酸根离子组成的化合物,NH3•H2O属于碱,故C错误;
D、酸是指在电离时产生的阳离子全部是氢离子的化合物,NaHSO4属于盐,不是酸,故D错误;
故选A.
点评 本题难度不大,熟练掌握酸碱盐与氧化物的特征、组成及化学式的书写是正确解答此类题的关键所在.

练习册系列答案
相关题目
4.已知离子的氧化性:Fe3->SO${\;}_{4}^{2-}$,离子的还原性:S2->I->Fe2+,向FeCl3溶液中加入下列物质,溶液颜色不是因发生化学变化而改变的是( )
| A. | SO2 | B. | Na2S | C. | KI | D. | CuSO4 |
19.符合如图阴影部分的物质是( )
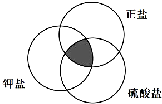

| A. | K2SO3 | B. | Na2SO4 | C. | K2SO4 | D. | KCl |
16.下列说法正确的是( )
| A. | CO(g)的燃烧热为283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=2×(-283.0)kJ•mol-1 | |
| B. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4 kJ/mol | |
| C. | FeSO4、Na2CO3、FeCl3、Mg(NO3)2溶液加热蒸发结晶都得不到相应的溶质 | |
| D. | 由△G=△H-T△S可知,△H>0且△S<0的反应肯定不能发生 |
3.类推是化学中常用的思维方法,以下四个类推结果正确的是( )
| A. | 氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物 | |
| B. | 酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸和碱的反应 | |
| C. | 燃烧一般都伴随着发光,发热现象,所以有发光.发热的现象就是燃烧 | |
| D. | 醇类物质在空气中燃烧生成CO2 和H2O,甲醇是醇类的一种,所以甲醇在空气中燃烧生成CO2 和H2O |
20.对于固定体积的密闭容器中进行的气体反应A(g)+B(g)?C(s)+2D(g),可以说明在恒温下已达到平衡状态的是( )
①反应容器中压强不随时间变化而变化
②A气体和B气体的生成速率相等
③混合气体的平均摩尔质量不随时间变化而变化
④反应混合气体的密度不随时间变化而变化.
①反应容器中压强不随时间变化而变化
②A气体和B气体的生成速率相等
③混合气体的平均摩尔质量不随时间变化而变化
④反应混合气体的密度不随时间变化而变化.
| A. | ②③ | B. | ③④ | C. | ①③ | D. | ①④ |
18.在乙醇CH3CH2OH中化学键如图,则下列说法中正确的是( )
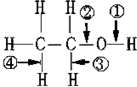

| A. | 当该醇发生催化氧化时,被破坏的键是②③ | |
| B. | 当该醇与Na反应时,被破坏的键是① | |
| C. | 当该醇与羧酸发生酯化反应时,被破坏的键是② | |
| D. | 当该醇发生消去反应时,被破坏的键是①和④ |