题目内容
17.海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在.有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘: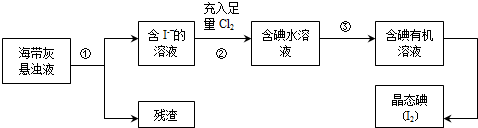
(提示:Cl2和I-可发生置换反应)
(1)灼烧海带时需要用到的实验仪器是ACDE(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.坩埚 B.烧杯 C.坩埚钳 D.三脚架 E.泥三角 F.酒精灯
(2)过程②中充入足量Cl2的目的是氧化碘离子,反应的离子方程式为2I-+Cl2=2Cl-+I2.
(3)操作③中所用的有机试剂是四氯化碳.
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂加入分液漏斗中,盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,不时旋开活塞放气,后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层.
a.上述G步操作的目的是平衡压力便于液体流出;
b.最后碘的有机溶液是通过漏斗下口获得(填“漏斗上口”或“漏斗下口”).
(5)若要检验提取碘后的水溶液中是否还含有单质碘,可以取样加入淀粉溶液,观察颜色变化.
(6)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察图所示实验装置,指出其明显错误有三处.
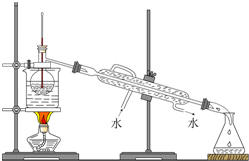
(7)进行上述蒸馏操作时,使用水浴的原因是受热比较均匀,温度容易控制.
分析 以海带为原料获得少量碘单质:将海带在坩埚中灼烧得到海带灰,将海带灰浸泡得到海带灰悬浊液,然后采用过滤的方法将残渣和溶液分离,得到含有碘化钾的溶液,向水溶液中通入足量Cl2,发生反应为2I-+Cl2=2Cl-+I2,向含有碘单质的溶液中加入萃取剂四氯化碳萃取蒸馏得到碘单质.
(1)根据实验操作步骤①灼烧来分析用到的实验仪器;
(2)氯气和碘离子能发生置换反应,碘离子被氧化为碘单质,据此写出反应的离子方程式;
(4)a.分液漏斗使用时:将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,可以平衡气压,不打开活塞,液体在大气压作用下无法流出;
b.四氯化碳的密度大于水,含有碘单质的四氯化碳在下层;
(5)根据碘单质遇到淀粉会变蓝色来检验是否还有碘单质;
(6)冷凝水应是下进上出,温度计水银球应与烧瓶支管口相平;
(7)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点.
解答 解:(1)灼烧固体物质一般使用(瓷)坩埚,转移坩埚需用坩埚钳,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯,
故答案为:ACDE;
(2)氯气具有强氧化性,碘离子具有还原性,二者能发生氧化还原反应生成碘和氯离子,离子方程式为:2I-+Cl2=2Cl-+I2,
故答案为:氧化碘离子;2I-+Cl2=2Cl-+I2;
(4)a.分液漏斗使用时:将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,可以平衡气压,便于液体流出,
故答案为:平衡压力便于液体流出;
b.分液漏斗中的下层液体从下口漏出,上层液体从上口倒出,萃取剂四氯化碳的密度大于水,含有碘单质的四氯化碳在下层,从下口漏出,
故答案为:漏斗下口;
(5)提取碘后的水溶液中若是含有单质碘,则遇到淀粉会变蓝色,可以取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色(如果变蓝,说明还有单质碘),
故答案为:淀粉溶液;
(6)冷凝水应是下进上出,温度计测量蒸气的温度,温度计水银球应与烧瓶支管口相平,烧杯需要垫石棉网加热,其错误有三处,
故答案为:三;
(7)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点,
故答案为:受热比较均匀,温度容易控制.
点评 本题考查海带成分中碘元素的检验,题目难度中等,明确物质的分离方法及碘单质的检验是解答的关键,试题侧重考查学生的分析能力及化学实验能力.

| A. | 氧化物:CO、NO2、SO2、H2O | |
| B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| C. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3•H2O | |
| D. | 酸:H2SO4、HNO3、H2CO3、NaHSO4 |
①反应前后,溶液中离子浓度基本保持不变的有Na+ ②有胶状物质生成
③有气体产生 ④溶液颜色发生变化 ⑤溶液中共发生了2个氧化还原反应.
| A. | ①②③④ | B. | ①②③④⑤ | C. | ①③④⑤ | D. | ②④⑤ |
| A. | 96倍 | B. | 48倍 | C. | 24倍 | D. | 12倍 |
| A. | 钠在苯与水的界面处反应并可能上浮下沉 | |
| B. | 钠停留在苯层中不发生反应 | |
| C. | 钠在苯的液面上反应并四处游动 | |
| D. | 钠在水层中反应并四处游动 |
| A. | ${\;}_{a+2}^{a+b-2}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{b}^{a}$R | D. | ${\;}_{a+2}^{a+b}$R |
| A. | 1.0×10-4 mol/L | B. | 2.0×10-4 mol/L | C. | 1.0×10-5 mol/L | D. | 2.0×10-5 mol/L |
| A. | 熔化的硝酸钾 | B. | 硝酸钾晶体 | C. | 硝酸钾水溶液 | D. | 稀硝酸 |
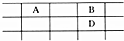 只有C是金属,D的单质是黄色固体.
只有C是金属,D的单质是黄色固体.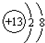 .
.