题目内容
下列物质在水溶液中电离方程式正确的是
- A.Na2CO3=Na2++CO32-
- B.NaHSO4=Na++H++SO42-
- C.KClO3=K++Cl-+3O2-
- D.NaOH=Na++H++O2-
B
分析:强电解质在溶液中能完全电离,弱电解质则部分电离,离子团在电离方程式中不能拆开.
解答:A、碳酸钠是强电解质,能完全电离出钠离子和碳酸根离子,即Na2CO3=2Na++CO32-,故A错误;
B、硫酸氢钠能完全电离出Na+、H+、SO42-,显较强的酸性,故B正确;
C、氯酸根离子团不能拆开,应为:KClO3=K++ClO3-,故C错误;
D、氢氧化钠是强碱,能完全电离出钠离子和氢氧根离子,即NaOH=Na++OH-,故D错误.
故选B.
点评:本题考查学生电离方程式的书写知识,可以根据所学知识进行回答,较简单.
分析:强电解质在溶液中能完全电离,弱电解质则部分电离,离子团在电离方程式中不能拆开.
解答:A、碳酸钠是强电解质,能完全电离出钠离子和碳酸根离子,即Na2CO3=2Na++CO32-,故A错误;
B、硫酸氢钠能完全电离出Na+、H+、SO42-,显较强的酸性,故B正确;
C、氯酸根离子团不能拆开,应为:KClO3=K++ClO3-,故C错误;
D、氢氧化钠是强碱,能完全电离出钠离子和氢氧根离子,即NaOH=Na++OH-,故D错误.
故选B.
点评:本题考查学生电离方程式的书写知识,可以根据所学知识进行回答,较简单.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
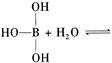
 H++B(OH)4-,该反应中的碱是
H++B(OH)4-,该反应中的碱是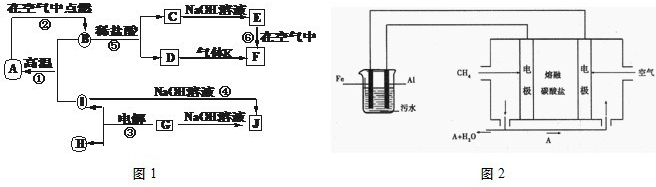
 NH3?H2O+H+
NH3?H2O+H+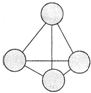 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.

 。
。
 。
。