题目内容
如将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为CH4+10OH—-8e- CO32—+7H2O,下列叙述正确的是
CO32—+7H2O,下列叙述正确的是
| A.通入甲烷的一极为正极 |
| B.通入氧气的一极发生氧化反应 |
| C.该电池在工作时,溶液中的阴离子向正极移动 |
D.该电池总反应为CH4+2O2+2OH— CO32— +3H2O CO32— +3H2O |
D
解析试题分析:A、通入甲烷的一极失去电子为负极,错误; B.通入氧气的一极得到发生还原反应,错误;C.该电池在工作时,负极需要消耗OH—,故溶液中的阴离子向负极移动。
考点:燃料电池的基本应用。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。下列说法不正确的是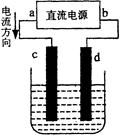
| A.a为正极、b为负极 |
| B.c为阳极、d为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成下图所示的原电池。下列判断不正确的是

A.为证明反应的发生,可取甲中溶液加入酸性高锰酸钾溶液 |
B.反应开始时,甲中石墨电极上Fe3+被还原,乙中石墨电极上发生氧化反应 |
C.电流计读数为零时,在甲中加入FeCl2固体后,甲中石墨电极为负极 |
| D.此反应正反应方向若为放热反应,电流计读数为零时,降低温度后,乙中石墨电极为负极 |
下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。当电池工作时,下列有关说法正确的是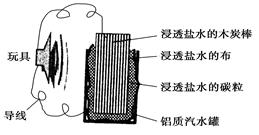
| A.电池的能量转化率可达100% |
| B.铝罐是电池的负极 |
| C.炭棒应与玩具电机的负极相连 |
| D.电池工作一段时间后炭棒和碳粒的质量会减轻 |
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
| A.正极反应为AgCl +e-=Ag +Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
下列说法不正确的是
| A.光催化还原水制氢比电解水制氢更节能环保、更经济 |
| B.氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 |
| C.某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V=10-12L)内的数个目标分子,据此可推算该检测技术能测量到细胞内浓度约为10-12~10-11mol·L-1的目标分子 |
| D.向汽油中添加甲醇后,该混合燃料的热值不变 |
用惰性电极电解一定量的硫酸铜溶液,实验装置如图1所示。电解过程中的实验数据如图2所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标况)。则下列说法中正确的是

| A.电解过程中,b电极表面先有红色物质析出,然后才有气泡产生 |
| B.从开始到Q点时收集到的混合气体的平均相对分子质量为17 |
| C.曲线OP 段表示H2和O2混合气体的体积变化,曲线PQ段表示O2的体积变化 |
| D.a电极上发生反应的方程式为:2H+ + 2e- = H2↑和4OH-–4 e-=2H2O+ O2↑ |
 导线
导线