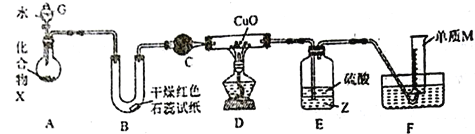
题目内容
【题目】硫酸四氨合铜(Ⅱ)是一种重要的染料及农药中间体。a、b、c、d、e是硫酸四氨合铜(Ⅱ)中原子序数依次增大的五种元素。
(1)该配合物中,配体的电子式为________;五种元素中电负性最大的是________ (填元素名称),基态b原子的价层电子排布图为______________________。
(2)a和其它4种元素形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物是_______________、______________(填化学式,写出两种)。
(3)基态e原子中,核外占据最高能层的电子的电子云轮廓图形状为________形;c、d元素形成的分子dc3中心原子杂化轨道类型为________。
(4)元素d可以形成两种常见含氧酸,其通式为(HO)mdOn,请根据结构与性质的关系解释该两种含氧酸酸性强弱的原因是_____________________________。
(5)与铜同周期的锌为六方最密堆积晶体,晶胞如图。锌的原子半径为r,在正四面体A1A2A4B中,点A1到A2A4B平面的距离为h,NA是阿伏加德罗常数的值。锌原子的配位数为________,晶胞参数(长、宽、高)依次为________,晶体密度的计算式为__________。

【答案】 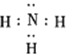 氧
氧 ![]() H2O2 N2H4 球 sp2 由通式可知,H2SO4的n值大于H2SO3,S的正电性越高,导致S-O-H中O的电子向S偏移程度大,因而更易电离出H+,酸性更强 12 2r、2r、2h 65×2/(8hr2NASin60°)(或65×2/4
H2O2 N2H4 球 sp2 由通式可知,H2SO4的n值大于H2SO3,S的正电性越高,导致S-O-H中O的电子向S偏移程度大,因而更易电离出H+,酸性更强 12 2r、2r、2h 65×2/(8hr2NASin60°)(或65×2/4![]() hr2NA)(或
hr2NA)(或![]() )
)
【解析】(1)已知硫酸四氨合铜(Ⅱ)的化学式为Cu(NH3)4SO4,所以原子序数依次增大的五种元素a、b、c、d、e分别是H、N、O、S、Cu,其中的配体为NH3,其电子式为![]() ;根据电负性变化规律,一般地同周期从左到右逐渐增大,同主族从上到下逐渐减小,所以这五种元素中电负性最大的是氧元素;基态N原子的价层电子排布图为
;根据电负性变化规律,一般地同周期从左到右逐渐增大,同主族从上到下逐渐减小,所以这五种元素中电负性最大的是氧元素;基态N原子的价层电子排布图为![]() 。
。
(2)H与其它4种元素形成的二元共价化合物有NH3、N2H4、H2O、H2O2、H2S等,其中既含有极性共价键、又含有非极性共价键的化合物是H2O2、N2H4。
(3)基态Cu原子的价电子排布式为3d104s1,核外占据最高能层为4s,其电子云形状为球形;O、S两元素形成的分子SO3中,S原子的杂化轨道类型为sp2,即![]() (6+0)=3,需要形成三个杂化轨道,所以是sp2杂化。
(6+0)=3,需要形成三个杂化轨道,所以是sp2杂化。
(4)S元素可以形成两种常见含氧酸,其通式为(HO)mSOn,即亚硫酸为(HO)2SO,硫酸为(HO)2SO2,也就是说H2SO4的n值大于H2SO3的n值,使S原子的正电性增大,导致S-O-H中电子向S偏移程度增大,因而更易电离出H+,故硫酸的酸性更强。
(5)已知该晶体为六方最密堆积,所以其配位数为12;设锌的原子半径为r cm,点A1到A2A4B平面的距离为hcm,则该晶胞的参数为长为2r cm、宽为2r cm,高为正四面体高的2倍即2h cm;该晶胞中含有2个Zn原子,其质量为65×2/NA g,体积为8hr2Sin60°cm3,所以晶体的密度为65×2/(8hr2NASin60°)g/cm3(或65×2/4![]() hr2NA g/cm3)(或
hr2NA g/cm3)(或![]() g/cm3)
g/cm3)

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案