题目内容
【题目】写出下列化学反应的方程式
①制备氢氧化铁胶体的化学方程式 :_____________________________。
②硫酸镁溶液和氢氧化钡溶液反应的离子方程式:______________________。
③醋酸和氢氧化钠溶液反应的离子方程式:_______________________________。
④金属铝投入氢氧化钠溶液中的化学方程式:_______________________________。
⑤还原铁粉与水蒸气反应的化学方程式:__________________________________。
【答案】FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl Mg2++SO42-+Ba2++2OH-=Mg(OH)2↓+BaSO4↓ CH3COOH+OH-=CH3COO-+H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 3Fe+4H2O
Fe(OH)3(胶体)+3HCl Mg2++SO42-+Ba2++2OH-=Mg(OH)2↓+BaSO4↓ CH3COOH+OH-=CH3COO-+H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
【解析】
根据反应事实,书写常见反应的化学方程式和离子方程式。
①将饱和三氯化铁溶液滴入沸水中制备氢氧化铁胶体,化学方程式为FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
②硫酸镁溶液和氢氧化钡溶液混合生成两种沉淀,反应的离子方程式为Mg2++SO42-+Ba2++2OH-=Mg(OH)2↓+BaSO4↓。
③醋酸是弱电解质,在离子方程式中不能拆写。它和氢氧化钠溶液反应的离子方程式为CH3COOH+OH-=CH3COO-+H2O。
④金属铝与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
⑤还原铁粉与水蒸气高温反应生成四氧化三铁和氢气,化学方程式为3Fe+4H2O![]() Fe3O4+4H2 。
Fe3O4+4H2 。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案【题目】氨基羧酸盐在工业、农业、生活中都有着十分广泛的应用。氨基甲酸铵(NH2COONH4)可用做肥料、灭火剂、洗涤剂等,甘氨酸亚铁[(NH2CH2COO)2Fe]可用作补铁剂等。
已知:i. 氨基甲酸铵:白色固体,易分解,易水解;甘氨酸亚铁:易溶于水,难溶于乙醇。
ii. 甘氨酸:易溶于水,微溶于乙醇,两性化合物。
iii. 柠檬酸:易溶于水和乙醇,有较强酸性和还原性。
实验室制备方法如下:
I.制备氨基甲酸铵:反应的化学方程式为:2NH3(g)+CO2(g) ![]() NH2COONH4(g) △H<0
NH2COONH4(g) △H<0
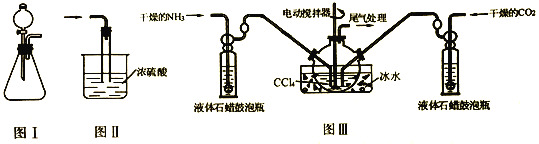
(1)图Ⅰ装置制备NH3,则所选试剂为_________________
(2)图Ⅲ装置制备氨基甲酸铵,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。(注:四氯化碳与液体石蜡均为惰性介质。)
①从反应后的混合物中分离出产品的实验操作是_______________(填操作名称)
②图Ⅱ装置进行尾气处理,则双通玻璃管的作用________________
③液体石蜡鼓泡瓶的作用是________________
④发生器用冰水冷却的原因是________________
II.制备(NH2CH2COO)2Fe:装置如图(夹持和加热仪器已省略), 用CO2气体将装置中空气排净,加入药品后,滴入柠檬酸并加热。反应结束后过滤,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
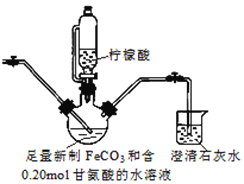
(3)烧杯中澄清石灰水的作用是_______________。
(4)柠檬酸可调节pH,体系pH与产率的关系如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
分析pH过低使产率下降的原因是___________;柠檬酸的作用还有_____(填序号)。
a.作反应终点指示剂 b.防止二价铁被氧化 c. 作催化剂 d. 促进FeCO3溶解
(5)乙醇的作用是________________。
(6)若产品的质量为m g,则产率为________________。

