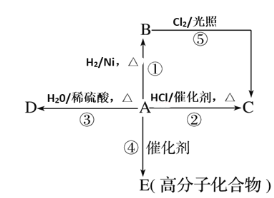
题目内容
【题目】(1)画出下列各微粒的结构示意图:L层电子数为K、M层电子数之和的原子形成的阴离子________;与Ne原子电子层结构相同的+1价阳离子________。
(2)写出下列物质或离子的电子式
N2 ________CO2 _________ OH- ____________NH![]() ___________
___________
(3)用电子式表示H2S和MgBr2的形成过程
H2S ________________________________
MgF2_______________________________________________
【答案】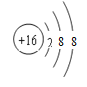
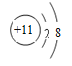
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
(1)各微粒的结构示意图:L层电子数为K、M层电子数之和的原子形成的阴离子为硫离子: ;与Ne原子电子层结构相同的+1价阳离子为钠离子:
;与Ne原子电子层结构相同的+1价阳离子为钠离子: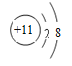 。故答案为:
。故答案为: ;
;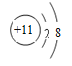 ;
;
(2)下列各物质或离子的电子式:
N2:两个氮原子各用3个电子,形成叁键,电子式为:![]() ;
;
CO2:二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:![]() ;
;
OH-:氧和氢之间形成1个共价键,原子团要加[ ],电子式为:![]() ;
;
NH![]() :氮和氢之间形成4个共价键,原子团要加[ ],电子式为:
:氮和氢之间形成4个共价键,原子团要加[ ],电子式为:![]() ;
;
故答案为:![]() ;
;![]() ;
;![]() ;
;![]() ;
;
(3)H2S为共价化合物,分子中氢原子与S原子之间形成1对共用电子对,用电子式表示形成过程为![]() ;
;
溴化镁是离子化合物,由溴离子与镁离子构成,用电子式表示的形成过程为![]() ;
;
故答案为:![]() ;
;![]() ;
;

 阅读快车系列答案
阅读快车系列答案【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089 nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高 正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低 负化合价 | -2 | -3 | -1 | -3 |
(1)⑧号元素在周期表中的位置是______________________________;表格中元素处于同一主族的是__________________________________。 (用元素符号表示)
(2)元素①和⑥能形成两种化合物,写出这两种化合物的电子式_______________________;________________________。
(3)④和⑤元素最高价氧化物对应的水化物酸性较强的是________(用物质化学式表示)。
【题目】下表为元素周期表的一部分,用请化学用语回答有关问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)C和H的元素符号是______和_______;
(2)表中A与F的氢化物反应的化学方程式___________,E的单质与其下一周期同族元素的最高价氧化物在高温下反应的化学方程式___________;最不活泼的元素________(填写元素符号)
(3)表中所列元素中最高价氧化物对应水化物碱性最强的是___________,酸性最强的是______ (填写化学式)
(4)表中能形成两性氢氧化物的元素是__________(填写元素符号),写出该元素的氢氧化物与A的最高价氧化物对应水化物反应的离子方程式__________________。