题目内容
用黄铜矿炼铜按反应物和生成物可将总反应可以写成:
CuFeS2 + SiO2 + O2→ Cu + FeSiO3 + SO2
事实上冶炼反应是分步进行的。(1)黄铜矿在氧气作用下生成硫化亚铜和硫化亚铁;(2)硫化亚铁在氧气作用下生成氧化亚铁,并与二氧化硅反应生成矿渣;(3)硫化亚铜与氧气反应生成氧化亚铜;(4)硫化亚铜与氧化亚铜反应生成铜。
1) 写出上述各个分步反应(1,2,3,4)的化学方程式。
2) 给出总反应方程式的系数。
3) 据最新报道, 有一种叫Thibacillus ferroxidans的细菌在氧气存在下可以将黄铜矿氧化成硫酸盐。反应是在酸性溶液中发生的。试写出配平的化学方程式。
4) 最近我国学者发现,以精CuFeS2矿为原料在沸腾炉中和O2 (空气)反应, 生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,成本降低了许多。实验结果如下:
回答如下问题:
(1) CuFeS2和O2主要反应的方程式为:
(2) 实际生产过程的沸腾炉温度为 600~620℃。控制反应温度的方法是:
(3) 温度高于600~620℃生成物中水溶性Cu (%)下降的原因是:
CuFeS2 + SiO2 + O2→ Cu + FeSiO3 + SO2
事实上冶炼反应是分步进行的。(1)黄铜矿在氧气作用下生成硫化亚铜和硫化亚铁;(2)硫化亚铁在氧气作用下生成氧化亚铁,并与二氧化硅反应生成矿渣;(3)硫化亚铜与氧气反应生成氧化亚铜;(4)硫化亚铜与氧化亚铜反应生成铜。
1) 写出上述各个分步反应(1,2,3,4)的化学方程式。
2) 给出总反应方程式的系数。
3) 据最新报道, 有一种叫Thibacillus ferroxidans的细菌在氧气存在下可以将黄铜矿氧化成硫酸盐。反应是在酸性溶液中发生的。试写出配平的化学方程式。
4) 最近我国学者发现,以精CuFeS2矿为原料在沸腾炉中和O2 (空气)反应, 生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,成本降低了许多。实验结果如下:
| 沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 | |
| 生 成 物 | 水溶性Cu/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 酸溶性Cu/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 | |
| 酸溶性Fe/% | 8.56 | 6.72 | 3.46 | 2.78 | 2.37 | 2.28 | |
(1) CuFeS2和O2主要反应的方程式为:
(2) 实际生产过程的沸腾炉温度为 600~620℃。控制反应温度的方法是:
(3) 温度高于600~620℃生成物中水溶性Cu (%)下降的原因是:
(1)2CuFeS2 + O2 =Cu2S + 2FeS +SO2 (1分)
(写S、SO3不写SO2不得分)
FeS + O2 =" FeO" + SO2 (1分)
(写S、SO3不写SO2不得分)
FeO + SiO2 = FeSiO3 (1分)
(写其他产物不得分)
2Cu2S + 3O2 = 2Cu2O+ 2SO2 (1分)
(写S、SO3不写SO2不得分)
Cu2S+ 2Cu2O =" 6Cu" + SO2 (1分)
(写S、SO3不写SO2不得分)
不配平不得分。
(2)2CuFeS2 + 2SiO2 + 5O2 =" 2Cu" + 2FeSiO3 + 4SO2
(3)4CuFeS2 + 2H2SO4 + 17O2 = 4CuSO4 + 2Fe2(SO4)3 + 2H2O (4分)
(注:不写硫酸铁而写硫酸亚铁给一半分)
(4)(1) 4CuFeS2 + 17O2 = 4CuSO4 + 2Fe2O3 + 8SO2 (4分)
(2) 控制加入CuFeS2的速度,因CuFeS2与O2反应放热。 (2分)
(3) CuSO4 =" CuO" + SO3 (2分)
(答SO2 + 1/2O2不扣分)
(注:(1)的反应产物不写氧化铁写氧化亚铁或四氧化三铁也可以给一半分。
虽然实际反应产物是氧化铁, 但对中学生, 做出正确判断根据可能不足。)
(写S、SO3不写SO2不得分)
FeS + O2 =" FeO" + SO2 (1分)
(写S、SO3不写SO2不得分)
FeO + SiO2 = FeSiO3 (1分)
(写其他产物不得分)
2Cu2S + 3O2 = 2Cu2O+ 2SO2 (1分)
(写S、SO3不写SO2不得分)
Cu2S+ 2Cu2O =" 6Cu" + SO2 (1分)
(写S、SO3不写SO2不得分)
不配平不得分。
(2)2CuFeS2 + 2SiO2 + 5O2 =" 2Cu" + 2FeSiO3 + 4SO2
(3)4CuFeS2 + 2H2SO4 + 17O2 = 4CuSO4 + 2Fe2(SO4)3 + 2H2O (4分)
(注:不写硫酸铁而写硫酸亚铁给一半分)
(4)(1) 4CuFeS2 + 17O2 = 4CuSO4 + 2Fe2O3 + 8SO2 (4分)
(2) 控制加入CuFeS2的速度,因CuFeS2与O2反应放热。 (2分)
(3) CuSO4 =" CuO" + SO3 (2分)
(答SO2 + 1/2O2不扣分)
(注:(1)的反应产物不写氧化铁写氧化亚铁或四氧化三铁也可以给一半分。
虽然实际反应产物是氧化铁, 但对中学生, 做出正确判断根据可能不足。)
本题由三个相互独立的问题组成,可以认为是三个题,占总分的较大比例,但由于都是有关黄铜矿的利用问题,因而被编在一起,而且多少相互之间可以起到“条件不同反应不同”的关联作用。与前两题相比,本题的第一部分比较简单,好像是命题人考虑着对前面的试题可能解答得不好的学生起一点安抚鼓励作用。写四个分步反应的方程式的考核点只是把题面的表述转换成化学方程式,但题面并没有指出生成物中的硫的形态。根据中学化学知识,可以想见它是SO2,大多数学生应该不会写错。其中第四个反应就是所谓“冰铜”反应,比较特殊,但试题已经告诉大家反应产物的含铜物质应该只有一种,即金属铜,这就降低了难度,可见应答时永远不应离开试题提供的知识背景。
问题(2)配平总方程式的系数,比较费事,考查机敏。配平的方法很多,条条大路通罗马。比较简单的是不管黄铁矿里的铜、铁和硫应当是什么价态的,假设铁是+2价的,铜也是+2价的,硫是-2价的,这样,铁在反应后价态不变,就省事多了。这种假设不会出现错误,其原因是氧化还原的电子得失总数是一定的。
问题(3)也是写方程式,熟悉过去竞赛试题的选手可能觉得似曾相识,但并非陈题。根据给出的信息,不难首先得出这样的结论:反应得到的溶液由CuSO4和Fe3(SO4)2组成。因为有氧气参加反应,铜和铁均应成水溶液中的稳定高价,似不会弄错。考虑到学生可能的错误,判分标准比较松。这个反应的关键是产物里要添硫酸根,为此题面对反应的条件作了说明:酸性溶液;但为避免暗示过多,没有说要加硫酸。
分析应答结果,许多学生因不会正确书写离子方程式和分子方程式二而失分。他们写的方程式是“非驴非马”的既非离子方程式又非分子方程式的“混杂”方程式。这中错误是严重的,不利于今后的学习,不能给分。我们建议正常课堂教学要针对学生这种错误来训练。
问题(4)比前面的试题更推进一步,信息是以表格中的数据的形式间接地呈现的。表格用沸腾炉的温度首先排除学生对“沸腾”二字的可能误解,这里的“沸腾”并非意味着炉子里有水之类的溶剂(试题设计人估计学生并没有固体在上行气流冲击下如同沸腾的那种工业反应器的概念,并没有考察这样专门的知识,但中学老师说,沸腾炉的概念在讲黄铁矿制硫酸中讲到的)。表格还用水溶性铜、酸溶性铜和酸溶性铁的信息表明,沸腾炉里的含铁产物肯定不是铁的硫酸盐,因为并没有说有水溶性铁,因而可以得出结论:燃烧产物中的铁是以氧化物的方式存在的。(这正是与本题一开始的传统冶炼反应不同之处,否则为什么是最新成果,而且是我国学者的成果呢?)至于铁的氧化物为什么随温度升高溶于酸的程度降低?本题没有要求作答。这个知识大大超过中学生的知识水平。其实,氧化物的酸溶性随煅烧或烧结温度升高而下降是一个普遍现象。例如用作炼钢炉衬里的氧化镁就是经过高温烧结的酸溶性很差的氧化物,还可以举出的典型物质是刚玉(Al2O3),用作坩埚等高温容器,酸溶性极差。这些化学知识似应在优秀中学生中间做点普及,不要以为碱性或两性金属氧化物都易溶于酸(热力学上要溶,动力学上不溶!)。本题给分充分考虑了中学生的知识水平,比较宽松。
问题(2)配平总方程式的系数,比较费事,考查机敏。配平的方法很多,条条大路通罗马。比较简单的是不管黄铁矿里的铜、铁和硫应当是什么价态的,假设铁是+2价的,铜也是+2价的,硫是-2价的,这样,铁在反应后价态不变,就省事多了。这种假设不会出现错误,其原因是氧化还原的电子得失总数是一定的。
问题(3)也是写方程式,熟悉过去竞赛试题的选手可能觉得似曾相识,但并非陈题。根据给出的信息,不难首先得出这样的结论:反应得到的溶液由CuSO4和Fe3(SO4)2组成。因为有氧气参加反应,铜和铁均应成水溶液中的稳定高价,似不会弄错。考虑到学生可能的错误,判分标准比较松。这个反应的关键是产物里要添硫酸根,为此题面对反应的条件作了说明:酸性溶液;但为避免暗示过多,没有说要加硫酸。
分析应答结果,许多学生因不会正确书写离子方程式和分子方程式二而失分。他们写的方程式是“非驴非马”的既非离子方程式又非分子方程式的“混杂”方程式。这中错误是严重的,不利于今后的学习,不能给分。我们建议正常课堂教学要针对学生这种错误来训练。
问题(4)比前面的试题更推进一步,信息是以表格中的数据的形式间接地呈现的。表格用沸腾炉的温度首先排除学生对“沸腾”二字的可能误解,这里的“沸腾”并非意味着炉子里有水之类的溶剂(试题设计人估计学生并没有固体在上行气流冲击下如同沸腾的那种工业反应器的概念,并没有考察这样专门的知识,但中学老师说,沸腾炉的概念在讲黄铁矿制硫酸中讲到的)。表格还用水溶性铜、酸溶性铜和酸溶性铁的信息表明,沸腾炉里的含铁产物肯定不是铁的硫酸盐,因为并没有说有水溶性铁,因而可以得出结论:燃烧产物中的铁是以氧化物的方式存在的。(这正是与本题一开始的传统冶炼反应不同之处,否则为什么是最新成果,而且是我国学者的成果呢?)至于铁的氧化物为什么随温度升高溶于酸的程度降低?本题没有要求作答。这个知识大大超过中学生的知识水平。其实,氧化物的酸溶性随煅烧或烧结温度升高而下降是一个普遍现象。例如用作炼钢炉衬里的氧化镁就是经过高温烧结的酸溶性很差的氧化物,还可以举出的典型物质是刚玉(Al2O3),用作坩埚等高温容器,酸溶性极差。这些化学知识似应在优秀中学生中间做点普及,不要以为碱性或两性金属氧化物都易溶于酸(热力学上要溶,动力学上不溶!)。本题给分充分考虑了中学生的知识水平,比较宽松。

练习册系列答案
相关题目
 5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
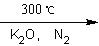 (C5H5)2 Fe+H2。
(C5H5)2 Fe+H2。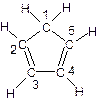 (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),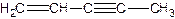 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________;