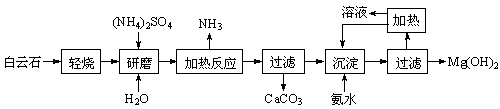
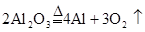题目内容
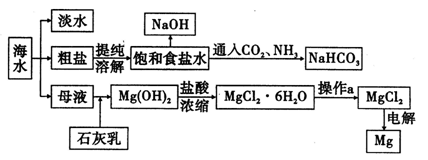
锰锌铁氧体可用于隐形飞机上吸收雷达波涂料。现以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下:
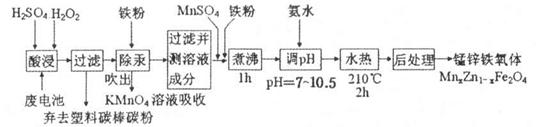
(1)酸浸时,二氧化锰被双氧水还原的化学方程式为_______。
(2)活性铁粉除汞时,铁粉的作用是______ (填“氧化剂”或“还原剂”或“吸附剂”)。
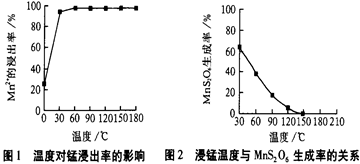
(3)除汞是以氮气为载气吹入滤液带出汞蒸汽经KMnO4溶液进行吸收而实现的。如下图是KMnO4溶液处于不同pH时对应的Hg去除率变化图,图中物质为Hg与 MnO4-在该pH范围内的主要产物。
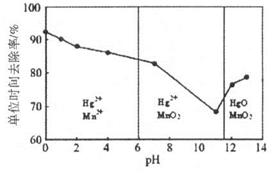
①请根据该图给出pH对汞去除率影响的变化规律:______。
②试猜想在强酸性环境下汞的单位时间去除率高的原因:______。
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该铁氧体组成____________。
(5)经测定滤液成分后同时加入一定量的MnSO4和铁粉的目的是______。

(1)酸浸时,二氧化锰被双氧水还原的化学方程式为_______。
(2)活性铁粉除汞时,铁粉的作用是______ (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液带出汞蒸汽经KMnO4溶液进行吸收而实现的。如下图是KMnO4溶液处于不同pH时对应的Hg去除率变化图,图中物质为Hg与 MnO4-在该pH范围内的主要产物。

①请根据该图给出pH对汞去除率影响的变化规律:______。
②试猜想在强酸性环境下汞的单位时间去除率高的原因:______。
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该铁氧体组成____________。
(5)经测定滤液成分后同时加入一定量的MnSO4和铁粉的目的是______。
(15分)(1)MnO2 + H2O2 + H2SO4=MnSO4 +O2↑ + 2H2O(3分)(2)还原剂(2分)
(3)①随pH的升高汞的去除率先降低后增加(2分)
②Mn2+具有催化作用,单位时间内去除率高(2分)
(4)MnO·4ZnO·5Fe2O3(3分)
(5)调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成(3分)
(3)①随pH的升高汞的去除率先降低后增加(2分)
②Mn2+具有催化作用,单位时间内去除率高(2分)
(4)MnO·4ZnO·5Fe2O3(3分)
(5)调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成(3分)
试题分析:(1)二氧化锰被双氧水还原,说明二氧化锰是氧化剂,得到电子。双氧水是还原剂失去电子,其氧化产物是氧气,所以反应的化学方程式为MnO2 + H2O2 + H2SO4=MnSO4 +O2↑ + 2H2O。
(2)铁是活泼的金属,所以活性铁粉除汞时,铁粉的作用是还原剂。
(3)①根据图像可知,随着pH的升高汞的去除率先降低后增加。
②根据图像可知,在强酸性条件下,MnO4-的还原产物是Mn2+,Mn2+具有催化作用,所以单位时间内去除率高。
(4)当x=0.2时,该物质的化学式可表示为Mn0.2Zn0.8Fe2O4,即Mn、Zn、Fe的原子个数之比=1:4:10,所以用氧化物形式可表示为MnO·4ZnO·5Fe2O3。
(5)根据锰锌铁氧化体组成可知,加入一定量的MnSO4和铁粉可以调节滤液离子的成分,使其符合水热后获得锰锌铁氧化体组成

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目