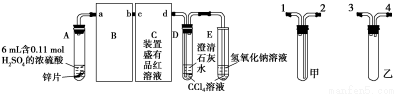
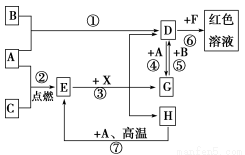
题目内容
将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=______________mL。
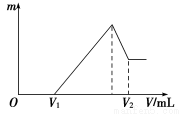
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=____________mL。
(3)若混合物仍为0.1 mol,其中镁粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
(1)0.06 440 (2)400 (3)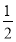 ≤a<1
≤a<1
【解析】(1)由图像可知:V1 mL的NaOH溶液是与过量H2SO4反应的,则与Mg、Al反应的为H2SO4:
2 mol-0.16 mol×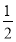 =0.12 mol。
=0.12 mol。
假设n(Mg)=x mol,n(Al)=y mol,
则有方程组:
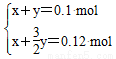 ,解得:x=0.06 mol,y=0.04 mol。
,解得:x=0.06 mol,y=0.04 mol。
当加入V2 mL NaOH溶液时,
得到Mg(OH)2沉淀和NaAlO2关系式为:
Mg2+~2OH-,Al3+~4OH-,
所以,V2=160 mL+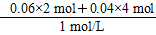 ×103 mL/L=440 mL。
×103 mL/L=440 mL。
(2)当Mg2+、Al3+刚好沉淀完全时,溶液中只有Na2SO4,关系式为2NaOH~H2SO4,
所以,V(NaOH)= 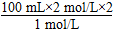 =400 mL。
=400 mL。
(3)当所得沉淀中无Al(OH)3时,NaOH溶液过量,反应后生成的溶质为:Na2SO4、NaAlO2。
则根据Na元素守恒:n(NaOH)=0.45 L×1 mol/L≥0.1 L×2 mol/L×2+0.1×(1-a)mol。
解得a≥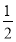 ,则满足此条件的a的取值范围是
,则满足此条件的a的取值范围是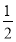 ≤a≤1。
≤a≤1。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
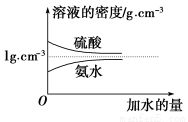
| 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与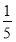 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________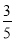 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。