题目内容
【题目】工业制取皮革加工中的鞣化剂硝酸铝,是用铝灰与烧碱、硝酸反应制得的。铝灰是铝、氧化铝和氧化铁的混合物。产品硝酸铝晶体为Al(NO3)3·nH2O。
已知偏铝酸盐能与一般的酸反应,如:NaAlO2+HNO3+H2O→NaNO3+Al(OH)3↓
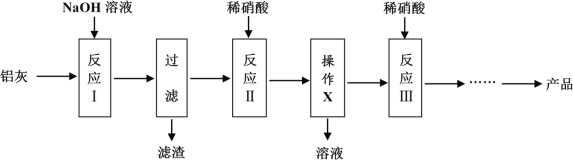
生产流程如图:
完成下列填空:
(1)用氢氧化钠固体配制30%的氢氧化钠溶液,除烧杯、玻璃棒外还需(选填编号)___。
A. B.
B. C.
C. D.
D.
说出流程中产生的滤渣的一种用途是___。制作一个过滤器需要___。流程中操作x的名称是____。
(2)反应Ⅱ加入的硝酸必须适量,原因是___。反应Ⅲ加入的硝酸要稍过量,原因是___。
(3)从反应Ⅲ所得的溶液制成产品的步骤依次为减压蒸发,___,过滤,___,低温烘干。
(4)为测定所得的产品的纯度,质检人员称取产品Wg,溶于水配成500mL溶液,从中取出25.00mL,加入过量已知浓度的氨水充分反应后,剩余的氨水用已知浓度的盐酸溶液进行测定。通过计算便可得出产品的纯度。
①上述过程属于定量实验。其中除配制一定物质的量浓度的溶液外,还有一个是___,该实验过程中要进行多次读数,读数的方法是读出与___的刻度值。
②任意写出一个该测定过程中所涉及的化学反应的离子方程式:___。
【答案】B 作颜料(或炼铁) 漏斗和滤纸 过滤 硝酸不足或过量,都会使铝元素损耗,而浪费原料、降低产量 稍过量的硝酸可抑制硝酸铝水解,有利提取产品 (冷却)结晶 洗涤(晶体) (酸碱)中和滴定 滴定管内壁上白底蓝线的粗细交界处相平 Al3++3NH3H2O→Al(OH)3↓+3NH4+或NH3H2O+H+→NH4++H2O
【解析】
铝灰用氢氧化钠溶液溶解,铝、氧化铝反应生成偏铝酸钠,氧化铁不反应,过滤后形成滤渣,滤液中含有偏铝酸钠和未反应的NaOH,加入硝酸中和未反应的氢氧化钠,并将偏铝酸钠转化为氢氧化铝沉淀,再过滤分离,氢氧化铝沉淀再用硝酸溶解,得到硝酸铝溶液,经过一系列操作得到硝酸铝晶体,结合溶液的配制和物质的性质分析解答。
(1)用氢氧化钠固体配制30%的氢氧化钠溶液,需要用天平称量氢氧化钠,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌,因此除烧杯、玻璃棒外还需要的仪器是量筒;流程中产生的滤渣是氧化铁,可以用作红色颜料,也可以用于炼铁;制作一个过滤器需要漏斗和滤纸;根据图示,流程中操作x是分离溶液和沉淀,为过滤,故答案为:B;作颜料(或炼铁);漏斗和滤纸;过滤;
(2)硝酸属于强酸,可以溶解氢氧化铝沉淀,导致Al元素损失,因此反应Ⅱ加入的硝酸必须适量;反应Ⅲ加入的硝酸要稍过量,因为硝酸铝会水解,稍过量的硝酸可抑制硝酸铝水解,有利提取产品,故答案为:硝酸不足或过量,都会使铝元素损耗,而浪费原料、降低产量;稍过量的硝酸可抑制硝酸铝水解,有利提取产品;
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干,故答案为:冷却结晶;洗涤;
(4)①常见的定量实验包括配制一定物质的量浓度的溶液外,还有一个是(酸碱)中和滴定;中和滴定实验过程中要进行多次读数,读数的方法是读出与滴定管内壁上白底蓝线的粗细交界处相平的刻度值,故答案为:(酸碱)中和滴定;滴定管内壁上白底蓝线的粗细交界处相平;
②称取产品Wg,溶于水配成500mL溶液,从中取出25.00mL,加入过量已知浓度的氨水,硝酸铝与氨水反应生成氢氧化铝沉淀和硝酸铵,充分反应后,剩余的氨水用已知浓度的盐酸溶液进行测定,氨水与盐酸反应生成氯化铵和水,测定过程中所涉及的化学反应的离子方程式有Al3++3NH3H2O=Al(OH)3↓+3NH4+、NH3H2O+H+=NH4++H2O,故答案为:Al3++3NH3H2O=Al(OH)3↓+3NH4+或NH3H2O+H+=NH4++H2O。

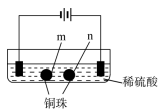
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:

(1)图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式______________________。
(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1_________K2(填”>”“=“或”<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v正(N2)=3v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g) ![]() N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)
N2(g)+3H2(g)的平衡常数K为______。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)____v逆(N2)(填”>”“=“或”<”)
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1 CuSO4溶液 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1 Al2(SO4) 3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1) 经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:_____。
(2) 经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。
已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色) +I2。
CuI↓(白色) +I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32。
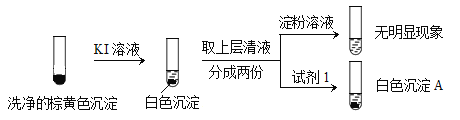
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu2+和SO32的理由是___________。
(3) 已知:Al2(SO4) 3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:
i.被Al(OH) 3所吸附;
ii.存在于铝的碱式盐中。
对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
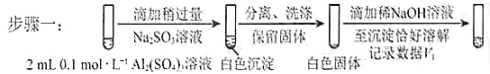
步骤二:_____________(按上图形式呈现) 。
(4) 根据实验,亚硫酸盐的性质有______。盐溶液间反应的多样性与___有关。