题目内容
【题目】(1)配平下列方程式(不需写出配平过程)
________H2S+_______HNO3 =________S↓ +________NO↑ +_______H2O
________S+________KOH=________K2S+________K2SO3 +________H2O
________KMnO4+________HCl(浓)=________KCl+________MnCl2+________Cl2↑+________H2O
(2)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O![]() 还原为Cr3+,该过程的离子反应方程式为________________________。
还原为Cr3+,该过程的离子反应方程式为________________________。
【答案】3 2 3 2 4 3 6 2 1 3 2 16 2 2 5 8 Cr2O72-+6Fe2++14H+= 2Cr3++6Fe3++7H2O
【解析】
(1)根据化合价升降法配平;
(2) 在酸性条件下,Cr2O![]() 与Fe2+反应生成Cr3+、Fe3+和水。
与Fe2+反应生成Cr3+、Fe3+和水。
(1)反应中S的化合价由-2价变为0价,N的化合价由+5变为+2,则最小公倍数为6,则S的系数为3,N的系数为2,根据原子守恒水的系数为4,方程式为3H2S+2HNO3 =3S↓ +2NO↑ +4H2O;
反应中S的化合价由0价变为-2价,S的化合价由0变为+4,则最小公倍数为4,则K2SO3的系数为1,K2S的系数为2,S的系数为3,根据原子守恒KOH的系数为6,水的系数为3,方程式为3S+6KOH=2K2S+K2SO3 +3H2O;
反应中Cl的化合价由-1价变为0价,生成的氯气中,Cl的系数为偶数个,Mn的化合价由+7变为+2,则最小公倍数为10,则KMnO4、MnCl2、KCl的系数为2,Cl2的系数为5,根据原子守恒HCl的系数为16,水的系数为8,方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
(2)在酸性条件下,Cr2O![]() 与Fe2+反应生成Cr3+、Fe3+和水,离子方程式为Cr2O72-+6Fe2++14H+= 2Cr3++6Fe3++7H2O。
与Fe2+反应生成Cr3+、Fe3+和水,离子方程式为Cr2O72-+6Fe2++14H+= 2Cr3++6Fe3++7H2O。

【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质 结构 信息 | 核外电子共有7种运动状态 | 原子的M层有1对成对的p电子 | 一种核素的中子数为35、质量数为64 | 有多种同位素,其中一种用做测量相对原子质量的校准 |
(1)写出B原子的电子排布式______。写出C原子的电子排布式______
(2)四种元素中非金属性最强的元素是______,金属性最强的元素是______,第一电离能最大的元素是______;
(3)一定条件下B、C单质间能反应,相应的反应方程式为______。
(4)已知S+6HNO3=H2SO4+6NO2↑+2H2O,该反应表明利用硝酸可以制取硫酸,但该反应不能用于说明氮元素的非金属性比硫元素的强,理由是______。
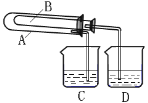
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品、用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A是制取CO2的装置。写出A中发生反应的方程式______________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _________ |
C | _________ | _________ |
D | _________ | _________ |
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________。
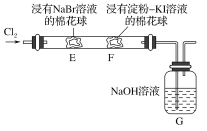
(4)某课外小组为了验证Na2CO3和NaHCO3的稳定性,设计了如图所示的实验装置,你认为在试管B中应放的物质是_______,C、D两个烧杯中的溶液分别是______、_______,Na2CO3粉末中混有少量NaHCO3,除去杂质的方法(写方程式)________。