题目内容
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.同温同压同体积的12C18O和14N2均含有14NA个电子
B.100mL0.1mol·L-1的氨水溶液中含有0.01NA个NH4+
C.14gC2H4和C3H4的混合物含有2NA个共用电子对
D.11.5gNa与一定量的氧气完全反应,一定失去0.5NA个电子
【答案】D
【解析】
A.同温同压同体积的12C18O和14N2,具有相同的物质的量,但是其物质的量不是1mol,不能求得它们所含的电子数,A错误;
B.NH3·H2O是弱电解质,在溶液中不能完全电离,因此NH4+数目小于0.01NA,B错误;
C.设C2H4的质量为xg,则C3H4的质量为(14-x)g。1molC2H4含有6mol共用电子对,1molC3H4含有8mol共用电子对,4gC2H4和C3H4的混合物含有![]() ,共用电子对数与C2H4的量有关,不能确定其共用电子对的数值,C错误;
,共用电子对数与C2H4的量有关,不能确定其共用电子对的数值,C错误;
D.Na和氧气反应时,失去电子,生成Na+,11.5gNa的物质的量为![]() ,失去的电子数为0.5NA,D正确。
,失去的电子数为0.5NA,D正确。
答案选D。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。
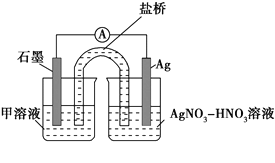
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。