题目内容
下列说法正确的是( ).
| A.向25℃纯水中加少量H2SO4(温度不变),c(H+)、c(OH-)乘积不变 |
| B.c(H+)越大,则pH越大,溶液的碱性越强 |
| C.pH=0的溶液,其中只含有H+,而无OH- |
| D.若溶液中c(OH-)=10-7 mol/L,则该溶液一定呈中性 |
A
KW是温度的函数,只与温度有关,向25℃纯水中加少量H2SO4(温度不变),c(H+)、c(OH-)乘积不变,正确;PH是-lgc(H+), 所以c(H+)越大,则pH越小,溶液的酸性越强,B错;pH=0的溶液,c(H+)为1,c(OH-)为10-14,C错;若25℃溶液中c(OH-)=10-7 mol/L,则该溶液呈中性,如果没有温度限制则不一定,如100℃时,中性溶液中c(OH-)=10-6 mol/L,D错。

练习册系列答案
相关题目
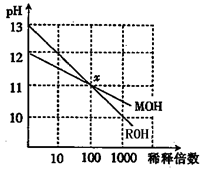
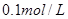 的氨水中,下列变化的图象合理的是
的氨水中,下列变化的图象合理的是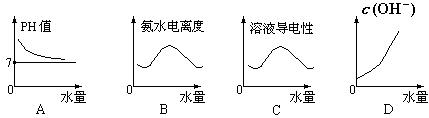

 。请在右图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。
。请在右图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。