题目内容
有一无色溶液,可能大量含有K+、Al3+、Ba2+、NH4+、Cl-、SO42-、SO32-、HCO3-中的几种.为确定其成分,做如下实验:①取部分溶液,加入足量Na2O2固体,有气体产生,最后也有沉淀产生;②另取①中静置后少量上层清液,加入足量硝酸酸化的AgNO3溶液,但最后没有白色沉淀产生.下列推断正确的是( )
| A、可能有Al3+、NH4+、Cl- | B、肯定有Al3+、Ba2+、HCO3 | C、可能没有K+、HCO3-、NH4+ | D、肯定没有Al3+、SO32-、SO42- |
分析:根据无色溶液,排除有颜色的离子;过氧化钠具有强氧化性,可氧化SO32-成SO42-,过氧化钠和水反应生成氢氧化钠和氧气,
①取部分溶液,加入足量Na2O2固体,有气体产生,最后也有沉淀产生;则沉淀的成分是碳酸钡;
②另取①中静置后少量上层清液,加入足量硝酸酸化的AgNO3溶液,但最后没有白色沉淀产生,因氯化银为白色沉淀,硫酸银微溶为白色沉淀,说明一定不含有Cl-,SO42-,SO32-,据此分析解答.
①取部分溶液,加入足量Na2O2固体,有气体产生,最后也有沉淀产生;则沉淀的成分是碳酸钡;
②另取①中静置后少量上层清液,加入足量硝酸酸化的AgNO3溶液,但最后没有白色沉淀产生,因氯化银为白色沉淀,硫酸银微溶为白色沉淀,说明一定不含有Cl-,SO42-,SO32-,据此分析解答.
解答:解:过氧化钠和水反应生成氢氧化钠和氧气,过氧化钠具有强氧化性,可氧化SO32-成SO42-,
①取部分溶液,加入足量Na2O2固体,过氧化钠先是和水反应生成氢氧化钠和氧气,该反应现象是有气体产生,肯定有氧气,可能含有氨气,最后也有沉淀产生,因过氧化钠足量,所以一定不存在氢氧化铝沉淀,因氯化银为白色沉淀,硫酸银微溶为白色沉淀,所以②另取①中静置后少量上层清液,加入足量硝酸酸化的AgNO3溶液,但最后没有白色沉淀产生说明一定不含有Cl-,SO42-,SO32-,所以①中过氧化钠和水反应生成氢氧化钠和HCO3-反应生成碳酸根离子,碳酸根离子和钡离子结合,最后也有沉淀产生为碳酸钡,
综上分析,一定存在Ba2+、HCO3-、一定不存在Al3+、Cl-、SO42-、SO32-,可能存在NH4+、K+,
故选D.
①取部分溶液,加入足量Na2O2固体,过氧化钠先是和水反应生成氢氧化钠和氧气,该反应现象是有气体产生,肯定有氧气,可能含有氨气,最后也有沉淀产生,因过氧化钠足量,所以一定不存在氢氧化铝沉淀,因氯化银为白色沉淀,硫酸银微溶为白色沉淀,所以②另取①中静置后少量上层清液,加入足量硝酸酸化的AgNO3溶液,但最后没有白色沉淀产生说明一定不含有Cl-,SO42-,SO32-,所以①中过氧化钠和水反应生成氢氧化钠和HCO3-反应生成碳酸根离子,碳酸根离子和钡离子结合,最后也有沉淀产生为碳酸钡,
综上分析,一定存在Ba2+、HCO3-、一定不存在Al3+、Cl-、SO42-、SO32-,可能存在NH4+、K+,
故选D.
点评:本题考查常见离子的检验,切入点是实验现象,根据实验现象和结合Na2O2的性质综合分析是解答本题的关键,题目难度中等.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
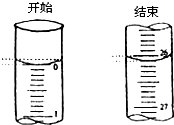 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
 )2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。
)2溶液至过量,有白色沉淀生成,沉淀量与加入Ba(OH)2溶液量的关系如右图所示。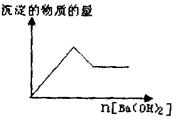
 存在的离子有 ;
存在的离子有 ;
