题目内容
10. 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:a>b>d>c(填编号)
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=3,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000mL,稀释过程pH变化如图;则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
分析 (1)电离常数越大,酸性越强,其盐的水解程度越小,盐溶液的pH越小;
(2)根据电离度计算溶液中氢离子浓度再求出pH;CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,c(OH-)增大,Kw不变;
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小;
(4)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-).
解答 解:(1)电离常数越大,酸性越强,其盐的水解程度越小,盐溶液的pH越小,由电离常数可知,酸性:CH3COOH>H2CO3>HClO>HCO3-,则pH由大到小的顺序是Na2CO3>NaClO>NaHCO3>CH3COONa,即:a>b>d>c;
故答案为:a>b>d>c;
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,则c(H+)=0.1mol/L×1%=0.001mol/L,所以pH=3;
A.CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,故A不选;
B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{n({H}^{+})}{n(C{H}_{3}COOH)}$,则稀释过程中比值变大,故B选;
C.稀释过程,促进电离,c(H+)减小,c(OH-)增大,c(H+)•c(OH-)=Kw,Kw不变,故C不选;
D.稀释过程,促进电离,c(H+)减小,c(OH-)增大,则$\frac{c(O{H}^{-})}{c({H}^{+})}$变大,故D选;
故答案为:3;BD;
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小,所以HX溶液中水电离出来的c(H+)大,
故答案为:大于;大于;
(4)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,
故答案为:9.9×10-7.
点评 本题考查盐类水解及酸性的比较、pH与酸的稀释等,注意水解规律中越弱越水解和稀释中强的变化大来分析解答,综合性较大,题目难度中等.

请回答下列问题:
(1)写出仪器A的名称:球形冷凝管;
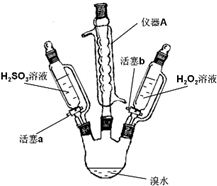
(2)实验记录如下:
| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| Ⅰ | 打开活塞a,逐滴加入H2SO3溶液至过量 | 烧瓶内溶液由橙黄色变为无色 | Br2的氧化性大于H2SO3 |
| Ⅱ | 向步骤Ⅰ所得溶液中逐滴加入H2O2溶液 | 刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色 | H2O2的氧化性大于Br2 |
(4)实验室常用Cl2通入NaBr溶液中制得单质溴,工业上常用电解饱和食盐水制备Cl2,装置如图所示,利用该装置,工业上除得到氯气外,还可以得到NaOH,H2(填化学式);装置中的离子交换膜Na+可以通过而OH-不能通过,的目的是避免Cl2与NaOH反应生成NaClO,影响NaOH的产量和纯度.

Ⅰ.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
N2(g)+2O2(g)=2NO2(g)△H2
H2O(l)=H2O(g)△H3
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=△H1-△H2+2△H3(用△H1、△H2、△H3)
Ⅱ.在温度为T1℃和T2℃时,分别将0.50molCH4和1.2molNO2充入体积固定的2L密闭容器中,发生上述可逆反应,测得不同时刻的n(CH4)数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1℃ | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2℃ | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
A.T1℃、前10min,V(NO2)=0.03mol/(L•min)
B.T1℃、反应达化学平衡状态时,CH4的转化率为80%
C.T2℃、反应在40min时处于平衡状态
D.T1>T2
(2)反应的平衡常数K(T1)>K(T2),△H<0,理由是由表中数据可知,T2时反应速率较大,所以T1<T2;升高温度平衡逆向移动,可知K(T1)>K(T2),所以正反应放热.
(3)T1℃时反应的平衡常数K为3.2.
(4)反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2,在下图中画出恒温,重新达到平衡过程中n(CH4)随时间变化的曲线(只要求画出n(CH4)的变化趋势,不需要准确画出再次平衡后n(CH4).
Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为NO2-e-+NO3-=N2O5.

| A. | 0.2 mol•L-1氨水中,c(OH-)与c(NH4+)相等 | |
| B. | 0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中一定是c(OH-)=c(H+) | |
| D. | 10mL0.02mol•L-1HCl溶液与10mL0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
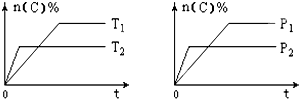 可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )| A. | 升高温度,平衡向逆反应方向移动 | |
| B. | 使用催化剂,C的物质的量分数增加 | |
| C. | 化学方程式系数a>c+d | |
| D. | 根据图象无法确定改变温度后平衡移动方向 |
| 实验目的 | 主要仪器 | 试剂 | |
| A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol•L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol•L-1),至中性时,溶液中的酸未被完全中和 | |
| D. | 同浓度,同体积的强酸与强碱溶液混合后,溶液的pH=7 |
 ;
; ;
;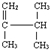 系统名称为2,3-二甲基-1-丁烯;
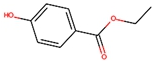
系统名称为2,3-二甲基-1-丁烯; 阿司匹林的相对分子质量为180,是一种常用的药品.
阿司匹林的相对分子质量为180,是一种常用的药品. .
.