题目内容
1.按要求填空(1)写出 4-甲基-2-乙基-1-戊烯的结构简式
 ;
;(2)对羟基苯甲酸乙酯
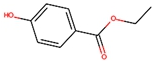 ;
;(3)
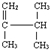 系统名称为2,3-二甲基-1-丁烯;
系统名称为2,3-二甲基-1-丁烯;(4)同时符合下列四个要求的水杨酸(邻羟基苯甲酸)的同分异构体共有2种.其核磁共振氢谱峰面积比为1:2:2:1.
①含有苯环; ②能发生银镜反应,不能发生水解反应;③在稀NaOH溶液中,1mol该同分异构体能与 2molNaOH发生反应;④只能生成两种一氯代产物.
分析 (1)将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有1个碳原子,据此就可以形成有机物的键线式;
(2)对羟基苯甲酸乙酯,是苯环上对位有羟基,羧基和乙醇发生酯化反应生成酯;
(3)选择含碳碳双键的最长碳链,从离双键的一段编号,确定取代基位置,写出名称;
(4)可与FeCl3溶液发生显色反应,说明含有酚羟基,能发生银镜反应,不能发生水解反应,说明含有-CHO、不含酯基,结合含苯环、一氯代物有两种,书写符合条件的 的同分异构体.有机物分子中的等效氢原子种类决定了其核磁共振氢谱总共峰的数目;
的同分异构体.有机物分子中的等效氢原子种类决定了其核磁共振氢谱总共峰的数目;
解答 解:(1)4-甲基-2-乙基-1-戊烯的结构简式为:CH3CH(CH3)CH2C(CH2CH3)=CH2,将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有1个碳原子,得到的键线式为: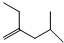 ,
,
故答案为: .
.
(2)对羟基苯甲酸乙酯,是苯环上对位有羟基,羧基和乙醇发生酯化反应生成酯,结构简式为: ,
,
故答案为: ;
;
(3) 系统命名得到名称2,3-二甲基-1-丁烯,
系统命名得到名称2,3-二甲基-1-丁烯,
故答案为:2,3-二甲基-1-丁烯;
(4)可与FeCl3溶液发生显色反应,说明含有酚羟基,能发生银镜反应,不能发生水解反应,说明含有-CHO、不含酯基,且含苯环、一氯代物有两种,符合条件的 的同分异构体有
的同分异构体有 、
、 ,共2种,有机物分子中的等效氢原子种类决定了其核磁共振氢谱总共峰的数目为:1:2:2:1,
,共2种,有机物分子中的等效氢原子种类决定了其核磁共振氢谱总共峰的数目为:1:2:2:1,
故答案为:2;1:2:2:1.
点评 本题考查了有机物的命名,结构简式、键线式、电子式的书写,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则、键线式的表示方法,试题有利于培养学生的规范答题能力,题目较简单.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
11.已知NA表示阿伏伽德罗常数的值,以下说法正确的是( )
| A. | 常温下,0.05mol•L-1Fe2(SO4)3溶液中含Fe3+数目为0.1NA | |
| B. | 1molFeCl3跟水反应完全转化成氢氧化铁胶体后,生成胶体粒子的数目为NA | |
| C. | 标准状况下,aL的氧气和氮气的混合物含有的原子数约为$\frac{a}{22.4}$×6.02×1023 | |
| D. | 常温常压下,8gO2含有4NA个电子 |
12.有关氧化物的叙述正确的是( )
| A. | 碱性氧化物一定是金属氧化物 | |
| B. | 金属氧化物一定是碱性氧化物 | |
| C. | 酸性氧化物、碱性氧化物一定都能与水反应生成相应的酸、碱 | |
| D. | 酸性氧化物一定是非金属氧化物 |
9.在标准状况下,11.2L某气体的质量是16g,该气体可能是( )
| A. | O2 | B. | N2 | C. | H2 | D. | CO2 |
6.下列说法正确的是( )
| A. | 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀 | |
| B. | 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀 | |
| C. | 钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同 | |
| D. | 无论哪种类型的腐蚀,其实质都是金属被还原 |
13.下列有关原电池和金属腐蚀的说法错误的是( )
| A. | 普通锌锰干电池碳棒是负极,锌片是正极 | |
| B. | 盛水的铁器,在空气与水交界处更容易锈蚀 | |
| C. | 为防止金属的腐蚀可在金属表面涂油漆、油脂 | |
| D. | 用盐酸与锌反应制取氢气,含有杂质的锌比纯锌产生氢气速度快 |
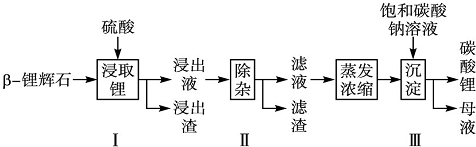
9.碳酸锂广泛应用于陶瓷和医药等领域.以β锂辉石(主要成分为Li2O•Al2O3•4SiO2,含有少量能溶于酸的铁的化合物和镁的化合物)为原料制备Li2CO3的工艺流程如下:
提示信息:
①下列四种离子完全沉淀时溶液pH值如下表:
②Li2SO4、LiOH常温下易溶于水,Li2CO3微溶于水.
回答下列问题:
(1)步骤Ⅰ前,β锂辉石要粉碎成细颗粒的目的是增加样品与H2SO4的接触面积,加快化学反应速率.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO${\;}_{4}^{2-}$,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入石灰石(填“石灰石”“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,可以除去的离子有Al3+、Fe3+,然后分离得到浸出液.
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有Fe2+、Mg2+、Ca2+.
(4)步骤Ⅲ中,生成沉淀的离子方程式为2Li++CO32-=Li2CO3↓.
提示信息:
①下列四种离子完全沉淀时溶液pH值如下表:
| 金属离子 | 完全沉淀pH |
| Fe2+ | 9.7 |
| Mg2+ | 12.4 |
| Fe3+ | 3.2 |
| Al3+ | 5.2 |
回答下列问题:
(1)步骤Ⅰ前,β锂辉石要粉碎成细颗粒的目的是增加样品与H2SO4的接触面积,加快化学反应速率.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO${\;}_{4}^{2-}$,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入石灰石(填“石灰石”“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,可以除去的离子有Al3+、Fe3+,然后分离得到浸出液.
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有Fe2+、Mg2+、Ca2+.
(4)步骤Ⅲ中,生成沉淀的离子方程式为2Li++CO32-=Li2CO3↓.

10. 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:
请回答下列问题:
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:a>b>d>c(填编号)
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=3,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000mL,稀释过程pH变化如图;则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:a>b>d>c(填编号)
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=3,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000mL,稀释过程pH变化如图;则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
 合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.
合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.