题目内容
14.下列物质的物质的量最多的是( )| A. | 56g N2 | B. | 1.5molO2 | ||
| C. | 标准状况下22.4LCl2 | D. | 3.01×1023个SO2分子 |
分析 根据n=$\frac{m}{M}$计算氮气物质的量,根据n=$\frac{V}{{V}_{m}}$计算氯气物质的量,根据n=$\frac{N}{{N}_{A}}$计算二氧化硫物质的量,进而比较判断.
解答 解:A.56g N2的物质的量为$\frac{56g}{28g/mol}$=2mol;
B.1.5molO2;
C.标准状况下22.4LCl2的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol;
D.3.01×1023个SO2分子的物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.5mol,
故选:A.
点评 本题考查物质的量有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
5.下列粒具有相同的质子数和电子数的是( )
| A. | OH-、H2O、F- | B. | NH3、NH4+、F- | C. | H3O+、NH4+、Cl- | D. | HCl、F2、H2S |
2.下列叙述中,正确的是( )
| A. | H2SO4的摩尔质量是98 | |
| B. | 等质量的O2和O3中所含的氧原子数不同 | |
| C. | 等质量的SO2与SO3中所含硫原子数之比为5:4 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L |
19.下列溶液中c(Cl-)最大的是( )
| A. | 1000ml 1mol•L-1氯化钠溶液 | B. | 75 ml 2mol•L-1氯化钙溶液 | ||
| C. | 250 ml 3mol•L-1氯化钾溶液 | D. | 150 ml 1mol•L-1氯化铁溶液 |
6.下列关于钠的说法正确的是( )
| A. | 钠是活泼的非金属 | B. | 钠与水反应放出氧气 | ||
| C. | 钠与水反应放出氢气 | D. | 钠不与盐酸反应 |
3.胶体区别于其它分散系的实质是( )
| A. | 胶体可发生丁达尔效应 | B. | 胶体粒子能够发生布朗运动 | ||
| C. | 胶体能透过滤纸但不能透过滤纸 | D. | 胶体粒子直径在1nm-100nm之间 |
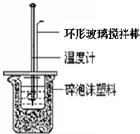 “中和热的测定”实验步骤为:
“中和热的测定”实验步骤为: