题目内容
【题目】如下图所示装置可以用来发生、洗涤、干燥、收集 (不考虑尾气处理)气体。该装置可用于:
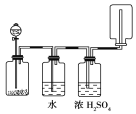
A.锌和盐酸生成氢气B.二氧化锰和浓盐酸生成氯气
C.碳酸钙和盐酸生成二氧化碳D.KClO3和MnO2生成氧气
【答案】A
【解析】
A.锌和盐酸发生反应生成氢气,制备、干燥及收集装置均符合上述要求,故A正确;
B.二氧化锰和浓盐酸生成氯气,反应需加热,氯气和水反应,氯气比空气重应用向上排气法,故B错误;
C.碳酸钙和盐酸生成二氧化碳,制备装置符合,二氧化碳也可少量溶解于水,二氧化碳比空气重,收集方法应用向上排气法,故C错误;
D.KClO3和MnO2生成氧气,反应需加热,生成的氧气微溶于水,氧气比空气重,收集方法也不对,故D错误;
故答案为A。

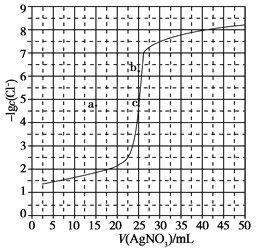
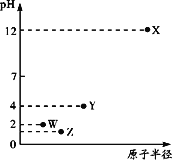
【题目】某澄清溶液中含有下表离子中的一种或多种。分别取它的水溶液两份进行实验,结果如下:
阳离子 | Fe2+、Fe3+、Al3+ |
阴离子 | SO32-、CO32-、SiO32-、I-、NO3- |
①向一份溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清;
②继续向①溶液中加入少许四氯化碳,震荡,静置,下层呈现紫红色,上层溶液呈现黄色;
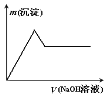
③向另一份溶液中加入过量氢氧化钠溶液,产生沉淀的质量与加入碱液的体积关系如图所示。
根据以上信息,回答下列问题:
(1)原溶液中肯定含有的离子是______________________________________________;
(2)①中生成的气体是______________(填化学符号),它具有的性质是_____________(填字母序号);
A.无色无味 B.能被NaOH溶液吸收 C.属于大气污染物 D.难溶于水
(3)①中发生反应的离子方程式有_______________________________________________。
(4)③中沉淀溶解的化学反应方程式是________________________________________。
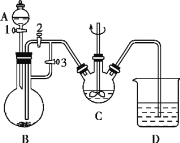
【题目】足量锌与一定量浓H2SO4充分在加热下反应生成会SO2和H2的混合气体。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中含有SO2和H2。取一定量的Zn置于b中,向a中加入100mL 18mol·L-1的浓硫酸,经过一段时间,恰好完全反应。
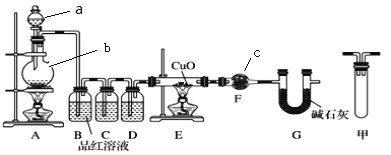
①填写仪器名称:c___________。
②实验开始前应先检验装置的气密性,请回答如何检验装置A的气密性___________。
③用化学方程式表示产生SO2的原因______________。
④U型管G的作用为__________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥实验结束后测得装置F增重18.0g,计算实验开始时加入的Zn的质量为________g。你认为实际消耗Zn的质量应比计算值____________。(填“大”、“小”或“相同”)
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。
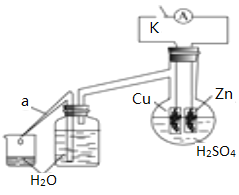
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是________。