题目内容
【题目】Ⅰ.某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置如图所示。回答下列问题:
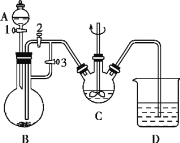
(1)C仪器的名称是___,FeCO3在其中生成,该装置中发生的主要反应的离子方程式为___。
(2)实验时首先打开活塞3,关闭活塞2,再打开活塞1向B中滴加盐酸,其目的是___,关闭活塞1,一段时间后,再关闭活塞___打开活塞__,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。
Ⅱ.乳酸亚铁晶体((CH3CH(OH)COO)2Fe·3H2O,Mr =288g/mol)是常用的补铁剂。乳酸亚铁可由乳酸与碳酸亚铁反应制得。
(3)将制得的FeCO3加入乳酸溶液中,再加入过量铁粉,75℃下搅拌使之充分反应,结束后,无需过滤,除去过量铁粉的反应方程式为2CH3CH(OH)COOH+Fe=(CH3CH(OH)COO)2Fe+H2↑;从上述所得溶液中获得乳酸亚铁晶体的方法是____、过滤、洗涤、干燥。
(4)该兴趣小组用KMnO4测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数。发现产品的质量分数总是大于100%,其原因可能是___。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1的Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2标准溶液19.70mL。滴定反应为Ce4++Fe2+=Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为____。
【答案】三颈烧瓶 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 排出装置中的空气,防止Fe2+被氧化 3 2 蒸发浓缩、冷却结晶 乳酸根离子中含有羟基,也能被酸性高锰酸钾溶液氧化 98.5%
【解析】
(1)C是三颈烧瓶,FeCl2和NH4HCO3反应生成FeCO3的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;故答案为:三颈烧瓶,Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(2)实验时首先打开活塞3,关闭活塞2,再打开活塞1向B中滴加盐酸,盐酸和铁反应生成FeCl2和氢气,利用氢气排出装置中的空气,防止Fe2+被氧化;
(3)乳酸亚铁晶体((CH3CH(OH)COO)2Fe·3H2O)带有结晶水,从溶液中获得结晶水合物不能直接加热蒸干,会失去结晶水,应采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法获得;故答案为:蒸发浓缩、冷却结晶;
(4)乳酸根离子中含有羟基,也能被酸性高锰酸钾溶液氧化,导致消耗的高锰酸钾增多,计算出的乳酸亚铁晶体的质量分数会大于100%。用铈(Ce)量法测定产品中Fe2+的含量的实验中,消耗n(Ce4+)=0.01970L×0.1000mol·L-1=1.970×10-3mol,根据滴定反应, n(Fe2+)= n[(CH3CH(OH)COO)2Fe·3H2O] = n(Ce4+)=1.970×10-3mol,在100 mL溶液里,n[(CH3CH(OH)COO)2Fe·3H2O]= 1.970×10-3×5mol,所以m[(CH3CH(OH)COO)2Fe·3H2O]= 1.970×10-3mol×5×288g/mol=1.970×10-3×5×288g,则产品中乳酸亚铁晶体的质量分数为![]() =98.5%;故答案为:乳酸根离子中含有羟基,也能被酸性高锰酸钾溶液氧化,98.5%。
=98.5%;故答案为:乳酸根离子中含有羟基,也能被酸性高锰酸钾溶液氧化,98.5%。