题目内容
13.现有如下两个反应:A.NaOH+HCl=NaCl+H2O
B.Zn+H2SO4=ZnSO4+H2↑
(1)上述能设计成原电池的反应是B(填序号,下同);写出负极材料和电极反应式:Zn,Zn-2e-=Zn2+;
(2)上述不能设计成原电池的反应是A,该原因是该反应为非氧化还原反应,没有电子转移.
分析 自发进行的放热的氧化还原反应能设计成原电池;在氧化还原反应中失电子化合价升高的金属作负极、不如负极活泼的金属或导电的非金属作正极,得电子发生还原反应的电解质为该原电池电解质.
解答 解:(1)A中反应前后各元素化合价不变,所以不属于氧化还原反应,属于复分解反应,B中Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以Zn发生氧化反应作负极,电极反应式为Zn-2e-=Zn2+,能设计成原电池,故答案为:B;Zn;Zn-2e-=Zn2+;
(2)能设计成的反应必须是自发进行的放热的氧化还原反应,A的反应为非氧化还原反应,没有电子转移,所以不能设计成原电池,故答案为:A;该反应为非氧化还原反应,没有电子转移.
点评 本题考查了原电池设计,明确原电池反应特点、正负极及电解质溶液的判断方法即可解答,在原电池反应中,一般来说,失电子化合价升高的金属单质作负极、得电子化合价降低的电解质为电解质溶液中的电解质,题目难度不大.

练习册系列答案
相关题目
1.准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol•L-1NaOH溶液滴定,测HCl溶液得浓度,下列说法正确的是( )
| A. | 滴定前滴定管尖嘴内无气泡,终点读数时有气泡,则测定结果偏小 | |
| B. | 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 | |
| C. | 用酚酞作指示剂,当锥形瓶中溶液由粉红色变无色时停止滴定 | |
| D. | 滴定时两眼应注视滴定管中液面的变化 |
8.以石油化工为基础的三大合成材料是( )
①陶瓷②塑料③水泥④合成橡胶⑤合成纤维⑥玻璃.
①陶瓷②塑料③水泥④合成橡胶⑤合成纤维⑥玻璃.
| A. | ①②③ | B. | ①③⑥ | C. | ②④⑤ | D. | ③⑤⑥ |
18.下列元素中,最高正价最高的是( )
| A. | 碳 | B. | 氮 | C. | 氧 | D. | 氟 |
5.下列说法中错误的是( )
| A. | CCl4可由CH4制得,可用于萃取碘水中的碘 | |
| B. | 乙醇、乙酸和乙酸乙酯能用饱和碳酸钠溶液鉴别 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 蒸馏装置中,温度计的水银球应插入到混合溶液中 |
2.下列有关叙述中,不正确的是( )
| A. | 硅在元素周期表中的位罝说明硅可用做半导体材料 | |
| B. | 石英可用于制造光导纤维 | |
| C. | 利用铝的金属活泼性可用做铝热剂材料 | |
| D. | 稀硫酸可以钝化铝,所以可以用铝制容器贮运稀硝酸 |
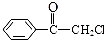 苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示,则苯氯乙酮不可能具有的化学性质是ce(填字母序号).
苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示,则苯氯乙酮不可能具有的化学性质是ce(填字母序号).