题目内容
常温下测得浓度均为0.1 mol·L—1的下列三种溶液的pH:
| 溶 质 | NaHCO3 | Na2CO3 | NaCN |
| pH | 8.4 | 11.6 | 11.1 |
下列说法中错误的是
A.溶液中阳离子物质的量之和的关系为:Na2CO3>NaHCO3=NaCN
B.相同条件下的酸性:H2CO3>HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度会使c(HCO3—)/ c(CO32—)增大
A
解析试题分析:A、溶液中阳离子物质的量之和,因三种溶液的体积不确定,无法比较物质的量的大小,错误;B、根据“越弱越水解”盐的水解规律,NaCN水解程度大于NaHCO3水解程度,所以酸性:H2CO3>HCN,正确;C、都存在水的电离平衡以及相应的弱酸根离子的水解平衡,正确;D、升高温度促进Na2CO3水解,平衡正向移动,会使c(HCO3—)/ c(CO32—)增大,正确。
考点:盐类的水解规律及应用。

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
pH=2的两种一元酸X和Y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加0.1 mol/L NaOH至pH=7,消耗NaOH溶液的体积为Vx、Vy,下列说法正确的是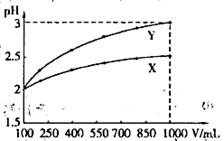
A.X为弱酸,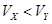 | B.Y为强酸,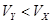 |
C.X为强酸,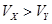 | D.Y为弱酸,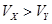 |
下列溶液中微粒浓度关系一定正确的是
| A.将pH=5的H2SO4溶液稀释1×103后,c(H+):c(SO42-)=2:1 |
B.醋酸与醋酸钠的 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) |
C.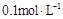 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) |
| D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)<c(C2O42-) |
常温下,往c1mo1/L的醋酸溶液中滴加同体积的c2 mo1/L的氢氧化钠溶液后,所得溶液的pH=7,则
| A.酸碱恰好中和 | B.c1=c2 |
| C.滴人酚酞溶液呈浅红色 | D.所得溶液c(Na+)=c(CH3COO一) |
在H2O+CH3COO-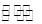 CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
| A.加入NaOH固体 | B.加入冰醋酸 | C.增大压强 | D.升高温度 |
对pH值相同的盐酸和醋酸两种溶液的说法正确的是
| A.中和碱的能力相同 | B.盐酸和醋酸的物质的量浓度相同 |
| C.OH-的物质的量浓度相同 | D.H+的物质的量浓度不同 |
25℃,向一定体积0.1mol/L的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中c(H+)与c(OH—)的变化关系如图所示,则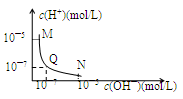
| A.M点所示溶液的导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO―)>c(Na+) |
| C.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
| D.M点和N点所示溶液中H2O的电离程度相同 |
常温下,用0.1000mol/LNaOH溶液分别滴定25.00mL0.1000mol/L盐酸溶液和
25.00mL0.1000mol/LCH3COOH溶液,滴定过程中pH变化曲线如下图所示。下列判断不正确的是
| A.滴定盐酸的pH变化曲线为图2 |
| B.在滴定CH3COOH溶液的过程中,始终都有c(Na+)+ c(H+)=c(CH3COO–)+c(OH–) |
| C.滴定CH3COOH溶液的过程中,当滴加12.5mLNaOH溶液时,溶液中离子浓度由大到小的顺序为c(CH3COO–)>c(Na+)>c(H+)>c(OH–) |
| D.当c(Na+)=c(CH3COO–)+ c(CH3COOH)时,溶液的pH<7 |