题目内容
3.实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:(1)取一定体积的0.1mol.L-1NaOH溶液放于烧杯中,加热煮沸后,再滴入几滴植物油;
(2)选择图中装置甲(填“甲”或“乙”),将(1)所得溶液加入到装置中并按图示组装好装置.
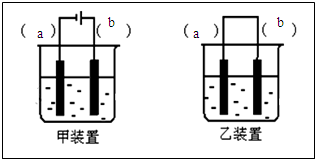
(3)在你选择的装置上标明电极材料分别为b-Fe、a-石墨
(4)实验中可在阳极附近溶液中看到稳定的白色Fe(OH)2沉淀.
(5)如果要看到白色沉淀转化为红褐色沉淀的现象,接下来的操作是将电极反向连接.
分析 (1)用煮沸的方法排出NaOH溶液中的氧气;
(2)由于铁与NaOH溶液不能发生自发的氧化还原反应,故不能设计成原电池,只能设计成电解池;
(3)在电解池中,要使铁能放电,铁应做阳极;
(4)由于铁做阳极,故Fe2+在阳极生成,则Fe(OH)2在阳极生成;
(5)要看到白色沉淀转化为红褐色沉淀的现象,只需让装置中有氧气生成即可.
解答 解:(1)由于Fe(OH)2有很强的还原性,故要想制得Fe(OH)2,必须排除装置和溶液中的氧气,而排出NaOH溶液中的氧气用煮沸的方法,故答案为:加热煮沸;
(2)原电池的反应必须是自发的氧化还原反应,而由于铁与NaOH溶液不能发生自发的氧化还原反应,故不能设计成原电池,只能设计成电解池,故答案为:甲;
(3)在电解池中,要使铁能放电变为Fe2+,铁应做阳极,即b为铁棒,阴极可以选择惰性电极,比如碳棒,即a为碳棒,故答案为:b-Fe;a-石墨;
(4)由于铁做阳极,则阳极上铁放电:Fe-2e-=Fe2+,故Fe2+在阳极生成,则Fe(OH)2在阳极生成,故答案为:阳极附近溶液中;
(5)要看到白色沉淀转化为红褐色沉淀的现象,只需让装置中有氧气生成即可,则只需让电极反向连接,则此时阳极为C棒,铁棒为阴极,则此时阳极上OH-放电生成氧气,会将Fe(OH)2氧化为Fe(OH)3,使白色沉淀转化为红褐色沉淀,故答案为:将电极反向连接.
点评 本题考查了Fe(OH)2的制取,应注意的是Fe(OH)2有很强的还原性,要防氧化,故采取加热煮沸以及加植物油等方法来防氧化.

练习册系列答案
相关题目
18.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )
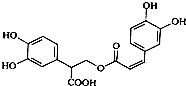

| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和含6mol H2发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、消去反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应 |
8.下列依据相关实验得出的结论正确的是( )
| A. | 将某无色气体通入品红溶液中,品红溶液褪色,则此气体一定是SO2 | |
| B. | 取少许某溶液并滴加数滴硫氰化钾溶液,无明显现象,再滴加数滴H2O2溶液,溶液变血红色,则原溶液中一定含Fe2+ | |
| C. | 在硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产生,说明Ksp(BaCO3)<Ksp(BaSO4) | |
| D. | 在淀粉溶液中加入稀硫酸并加热片刻再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 |
16.在“部分酸碱盐溶解性表”中存在“碳酸亚铁”.某学习小组设计实验探究碳酸亚铁的性质.
(一)制备碳酸亚铁.
将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体.
(1)写出离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(二)探究碳酸亚铁的热稳定性(加热仪器省略)
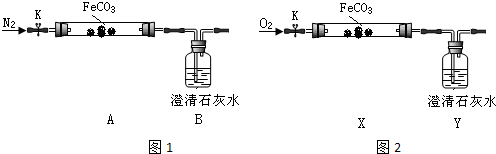
连接仪器、装药品.打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊.待固体分解完后,继续通入氮气至玻璃管冷却.
(2)先通入氮气的目的是排尽装置内空气,避免氧气干扰.B瓶现象能说明分解产物有二氧化碳.
(3)停止加热之前,是否拆开A、B之间橡胶管?答:否;理由是通入氮气,玻璃管内气压不会减小.
(三)探究碳酸亚铁还原性
【查阅资料】
①氧化亚铁是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁.
②碳酸亚铁在空气中灼烧生成氧化铁.
(4)探究碳酸亚铁和氧气反应的固体成分:
①【提出设想】
假设1 固体成分是氧化铁;
假设2 固体成分是四氧化三铁;
假设3氧化铁和四氧化三铁.
②【实验验证】连接仪器、装药品,打开止水夹K,通入氧气,加热玻璃管.Y瓶中澄清石灰水不产生沉淀时,停止加热,继续通入氧气至玻璃管冷却.
取少量玻璃管里固体于试管,滴加稀硫酸,微热,固体完全溶解.将溶液分成甲、乙两份溶液,进行后续实验.
【实验评价】③上述实验i(填:i或ii)不能确定样品成分.
【实验结论】根据上述实验结果,该小组得到碳酸亚铁在氧气中高温灼烧得到产物是溶液变红色,只证明有+3价铁,固体可能是氧化铁、四氧化三铁、氧化铁和四氧化三铁混合物.
(5)定量探究:取23.2g纯净固体碳酸亚铁,在空气中高温灼烧至恒重,称得固体质量净减7.2g.通过计算确定固体成分是氧化铁.
(一)制备碳酸亚铁.
将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体.
(1)写出离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(二)探究碳酸亚铁的热稳定性(加热仪器省略)

连接仪器、装药品.打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊.待固体分解完后,继续通入氮气至玻璃管冷却.
(2)先通入氮气的目的是排尽装置内空气,避免氧气干扰.B瓶现象能说明分解产物有二氧化碳.
(3)停止加热之前,是否拆开A、B之间橡胶管?答:否;理由是通入氮气,玻璃管内气压不会减小.
(三)探究碳酸亚铁还原性
【查阅资料】
①氧化亚铁是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁.
②碳酸亚铁在空气中灼烧生成氧化铁.
(4)探究碳酸亚铁和氧气反应的固体成分:
①【提出设想】
假设1 固体成分是氧化铁;
假设2 固体成分是四氧化三铁;
假设3氧化铁和四氧化三铁.
②【实验验证】连接仪器、装药品,打开止水夹K,通入氧气,加热玻璃管.Y瓶中澄清石灰水不产生沉淀时,停止加热,继续通入氧气至玻璃管冷却.
取少量玻璃管里固体于试管,滴加稀硫酸,微热,固体完全溶解.将溶液分成甲、乙两份溶液,进行后续实验.
| 实验编号 | 实验步骤 | 实验现象 |
| i | 向甲溶液滴加KSCN溶液 | 溶液变红色 |
| ii | 向乙溶液滴加酸性高锰酸钾溶液 | 溶液不褪色 |
【实验结论】根据上述实验结果,该小组得到碳酸亚铁在氧气中高温灼烧得到产物是溶液变红色,只证明有+3价铁,固体可能是氧化铁、四氧化三铁、氧化铁和四氧化三铁混合物.
(5)定量探究:取23.2g纯净固体碳酸亚铁,在空气中高温灼烧至恒重,称得固体质量净减7.2g.通过计算确定固体成分是氧化铁.
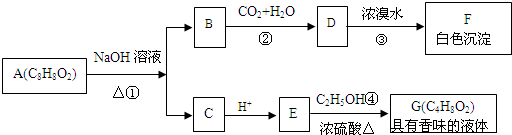
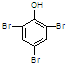 ;
;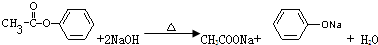 ;
;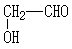 .
.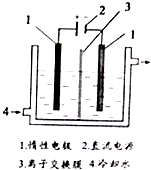 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题: 根据如图,回答问题.
根据如图,回答问题. ,GCH3COOCH2CH3
,GCH3COOCH2CH3