题目内容
【题目】I.实验室常用MnO2与浓盐酸反应制备Cl2(装置如图所示)。

(1)制备实验开始时,先检査装置气密性,接下来的操作依次是:_______(填序号)。
①往烧瓶中加入MnO2粉末;②加热;③往烧瓶中加入浓盐酸
(2)写出圆底烧瓶中发生反应的离子方程式_______________________。
(3)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法_______(填字母序号)。
a.将Cl-转化为AgCl沉淀,过滤,洗涤,干燥,称量沉淀的质量
b.与足量NaHCO3固体反应,将反应后气体直接用碱石灰吸收,测定生成气体的质量
c.与足量锌反应,测量生成气体标准状况下的体积
II.为测定某亚硫酸钠样品纯度,研究小组利用如下装置(装置图中夹持仪器已省略)进行实验。
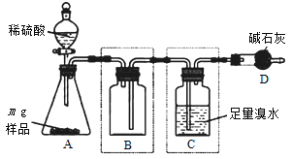
反应完全后,向C中溶液加入过量BaCl2溶液,过滤、操作①、干燥、称量,利用所得数据计算样品纯度。请回答:
(4)操作①的名称是____________。
(5)装置B的作用是______________________。
(6)最终所得固体质量为b g,则该样品中亚硫酸钠的质量分数为____________(用含字母m、b的代数式表示)。
(7)上述实验测得的样品纯度比实际偏低,为提高测定结果的准确度,可采取的改进措施是________________________________________(写一种)。
【答案】①③② MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O c 洗涤 安全瓶,防止倒吸
Mn2++Cl2↑+2H2O c 洗涤 安全瓶,防止倒吸 ![]() ×100% 增加将A、B中残留的SO2排入C中的装置
×100% 增加将A、B中残留的SO2排入C中的装置
【解析】
I. (1)按照实验操作步骤先将固体放入,再注入溶液,最后加热;
(2)依据实验室制备氯气的原理作答;
(3) a. 制备氯气时有氯化锰生成,不能直接计算得出剩余的HCl中的氯离子;
b. 碱石灰除了吸收二氧化碳还会吸收水蒸气;
c. 通过测量氢气的体积来确定氢离子浓度;
Ⅱ.装置A中亚硫酸钠与浓硫酸反应制备二氧化硫,装置B为安全瓶,可防止倒吸;装置C为计量装置,二氧化硫与足量溴水发生反应生成HBr和H2SO4,反应完全后,向C中溶液加入过量BaCl2溶液,过滤、洗涤、干燥、称地生成硫酸钡的质量,利用关系式法间接计算产品纯度,据此分析作答;
(1)实验室制备氯气应先检验装置气密性,然后烧瓶中加入二氧化锰粉末,而后加入浓盐酸再加热;
(2)实验室制备氯气的原理是二氧化锰在加热条件下与浓盐酸反应,离子方程式为MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)测定残余溶液中盐酸的浓度应测定残余溶液中含有的氢离子浓度,
a. 方案中测定的为氯离子浓度,制备氯气时有氯化锰生成,所以测定氯离子浓度不能代表残余液中盐酸的浓度,a项错误;
b. 方案中利用盐酸与碳酸氢钠溶液反应生成二氧化碳的量来确定氢离子的浓度,但是方案中利用碱石灰来吸收气体来测定气体质量,而碱石灰除了吸收二氧化碳还会吸收水蒸气,所以测定结果不准确,b项错误;
c. 锌与盐酸反应生成氢气,通过测量氢气的体积来确定氢离子浓度,进而得到盐酸浓度,方案c合理,c项正确;
II. (4)过滤后进行的操作名称为洗涤;
(5)装置B可以作安全瓶,防止倒吸;
(6)装置B中根据硫元素守恒计算,
Na2SO3~SO2~BaSO4
126g 233g
m bg
解得:m=![]() ,原样品中Na2SO3的质量分数为:
,原样品中Na2SO3的质量分数为:![]() ×100%,
×100%,
(7)为提高测定结果的准确度,增加将A、B中残留的SO2排入C中的装置,使二氧化硫充分反应而沉淀,故答案为:增加将A、B中残留的SO2排入C中的装置。