题目内容
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:
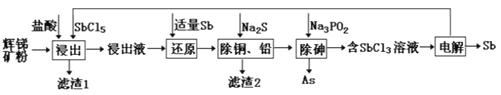
已知:①浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有___________(填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为_______________。
(3)“还原”时,被Sb还原的物质为___________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于_________;所加Na2S也不宜过多,其原因为_____________________________。
(5)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为_________。
(6)一种突破传统电池设计理念的镁-锑液态金属储能电池工作原理如图所示:
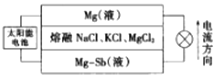
该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,Cl-向_____(填“上”或“下”)移动;放电时,负极的电极反应式为_________。
【答案】 SiO2 Sb2S3+3SbCl5=5SbCl3+3S SbCl5 9.04×10-24 mol·L-1 产生H2S等污染性气体或生成Sb2S3 3︰2 下 Mg -2e-=Mg2+
【解析】(1)二氧化硅与盐酸不反应;正确答案:SiO2;
(2)根据题给信息,Sb2S3与SbCl5反应生成单质硫,浸出液中含有SbCl3;因此反应产生SbCl3和S;正确答案:Sb2S3+3SbCl5=5SbCl3+3S;
(3)SbCl5 中+价Sb 被还原到+3价;正确答案:SbCl5;
(4)由Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29可知,Ksp(PbS)较大,在保证PbS沉淀的前提下,CuS已经沉淀;所以:Ksp(PbS)=9.04×10-29=c(Pb2+)c(S2-)=1.0×10-5×c(S2-);解出c(S2-)=9.04×10-24 mol/L;正确答案:9.04×10-24;加入过多的Na2S,硫离子与Sb3+形成Sb2S3或者硫离子与氢离子结合成硫化氢气体等;正确答案:产生H2S等污染性气体或生成Sb2S3;
(5)+3价Sb被氧化到+5价,还原到0价;根据电子得失守恒规律:被氧化的Sb与被还原的Sb的量之比为3:2;正确答案:3:2;
(6)根据电流方向可知:镁-锑液态金属极为正极,液镁为负极;放电时,氯离子向负极移动,充电时,氯离子向阳极移动,向镁-锑液态金属极方向移动;放电时溶液中的镁离子得电子变为金属镁;正极反应: Mg2++2e-=Mg;正确答案:下;Mg2++2e-=Mg;

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】(1)100°C时,KW=1.0×10﹣12,在该温度下,测得0.1mol/LNa2A溶液pH=6.
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,与盐酸相比,H2A溶液产生的H2____(填“多”、“少”或“一样多”).
(2)将0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)>c(B-)。
①混合溶液中c(B﹣)_____c(HB)(填“>”、“<” 或“=”);
②混合溶液中c(HB)+ c(B-)_____0.2mol/L(填“>”、“<”或“=”).
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
溶质 | CH3COOH | H2CO3 | HClO | HCN |
电离平衡常数Ka | 1.75×10-5 | Ka1=4.4×10-7 Ka2=4.7×10-11 | 3.2×10-8 | 6.2×10-10 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c( CH3COO-)﹣c( CH3COOH)=___mol/L(用数值列出计算式即可).
【题目】S2Cl2用作橡胶的低温硫化剂和粘结剂,由硫与限量氯气在50~60℃反应制得,进一步氯化可得SCl2、S2Cl2、SCl2的某些性质如下:
水溶性 | 密度(g/cm3) | 颜色 | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,通水即分解 | 1.687 | 金黄色 | -76℃ | 138℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | 樱桃红 | -122℃ | 59℃ |
用如图所示装置制备S2Cl2回答下列问题:
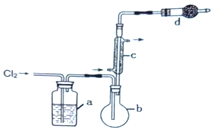
(1)写出S2Cl2的电子式_________。
(2)写出仪器c的名称_________;实验开始前先在b中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一固体薄层,这样做的目的是_________。
(3)实验时,b装置需加热。最好采用何种方式加热_________。
(4)b中的反应开始前,需排除装置中的空气,简述相关操作:_________。
(5)装置d中盛放的试剂是_________;其作用是①_________②_________。
(6)为了获得更纯净的S2Cl2,需要对产品进行的操作是_________。
(7)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的方程式_________。
【题目】为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是( )
选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
A | NH3(H2O) | 浓硫酸 | 洗气 |
B | KCl固体(I2) | KOH溶液 | 加热 |
C | H2O(Br2) | CCl4 | 分液 |
D | Cl2(HCl) | KOH溶液 | 洗气 |
A.A
B.B
C.C
D.D
