题目内容
x、y的原子序数均小于18,x原子K、L、M各电子层的电子数之比为1:4:1,它比y原子多3个电子,下列叙述正确的是( )
分析:K层容纳2个电子,L层容纳 8个电子,由于x原子K、L、M各电子层的电子数之比为1:4:1,所以x的M层有2个电子,则x为Mg元素,x比y原子多3个电子,所以y有9个电子,则y为F元素.
A、电子层排布相同的离子,核电荷数越大,离子半径越小;
B、氟气与水反应有氧气生成;
C、根据同周期、同主族原子半径递变规律判断;
D、摩尔质量的单位为g/mol等,以g/mol为单位数值上等于其相对分子质量.
A、电子层排布相同的离子,核电荷数越大,离子半径越小;
B、氟气与水反应有氧气生成;
C、根据同周期、同主族原子半径递变规律判断;
D、摩尔质量的单位为g/mol等,以g/mol为单位数值上等于其相对分子质量.
解答:解:K层容纳2个电子,L层容纳 8个电子,由于x原子K、L、M各电子层的电子数之比为1:4:1,所以x的M层有2个电子,则x为Mg元素,x比y原子多3个电子,所以y有9个电子,则y为F元素.
A、x为Mg元素、y为F元素,x离子与y离子的核外电子排布相同,核电荷数越大,离子半径越小,所以x离子半径小于y离子半径,故A错误;
B、氟气与水反应有氧气生成,氧气能使带火星的木条复燃,故B正确;
C、同周期自左而右,随核电荷数增大,原子半径减小,所以原子半径Cl<Mg,同主族自上而下,电子层增多,原子半径增大,所以原子半径Cl>F,所以原子半径Mg>Cl>F,即原子半径x>y,故C正确;
D、x、y形成的化合物为MgF2,摩尔质量为62g/mol,故D错误.
故选BC.
A、x为Mg元素、y为F元素,x离子与y离子的核外电子排布相同,核电荷数越大,离子半径越小,所以x离子半径小于y离子半径,故A错误;
B、氟气与水反应有氧气生成,氧气能使带火星的木条复燃,故B正确;
C、同周期自左而右,随核电荷数增大,原子半径减小,所以原子半径Cl<Mg,同主族自上而下,电子层增多,原子半径增大,所以原子半径Cl>F,所以原子半径Mg>Cl>F,即原子半径x>y,故C正确;
D、x、y形成的化合物为MgF2,摩尔质量为62g/mol,故D错误.
故选BC.
点评:本题以元素推断为载体,考查原子结构与位置关系、核外电子排布规律、半径比较、元素化合物性质等,难度不大,清楚核外电子排布规律是解题的关键,注意氟气与水的反应在卤素中的特殊性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2CA3(g)
2CA3(g)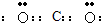

 已知短周期元素X、Y、Z的原子序数依次增大,且Z的原子序数等于X和Y的原子序数之和,Y的原子半径是同同期元素中最小的,Z元素在地壳中的含量居第二位.根据以上叙述下列说法中正确的是( )
已知短周期元素X、Y、Z的原子序数依次增大,且Z的原子序数等于X和Y的原子序数之和,Y的原子半径是同同期元素中最小的,Z元素在地壳中的含量居第二位.根据以上叙述下列说法中正确的是( )