题目内容
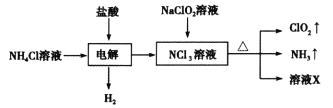
【题目】二氧化氯(ClO2)能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,下列说法正确的是
A.被氧化的元素是氯元素
B.氧化产物与还原产物的物质的量之比为l:1
C.消耗l mol还原剂,转移5 mol电子
D.净化1 L含CN-1.04 mg·L-1的废水,理论上需用2×l0-5mol C1O2
【答案】C
【解析】
试题分析:根据信息:二氧化氯和氰化钠(NaCN)反应,生成NaCl、CO2和N2,即2ClO2+2CN-=2CO2+N2+2Cl-氯元素化合价降低,被还原的元素是氯元素,故A错误;氧化产物是氮气、还原产物是氯离子,根据电子守恒,氧化产物与还原产物的物质的量之比为1:2,故B错误;NaCN是还原剂,氮元素化合价由-3升高为0,碳元素由+2升高为+4,消耗l mol还原剂,转移5mol电子,故C正确;

理论上需用0.04mol C1O2,故D错误。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |