题目内容
(14分)已知醋酸是日常生活中常见的弱酸。
(1)用pH试纸测定醋酸pH的操作是___________。
(2)常温下在 pH =5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是______ mol?L—1。
(3)用0.1000 mol?L—1NaOH溶液滴定20.00mL某浓度的CH3COOH溶液,部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述实验过程中的错误之处 (填序号)。上述实验与一定物质的量浓度溶液配制实验中用到的相同仪器___________________。
(4)某次滴定前滴定管液面如图所示,读数为________mL。
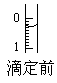
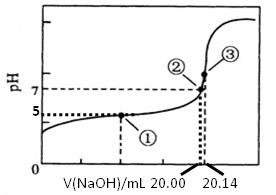
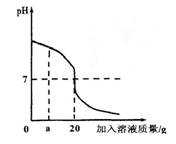
(5)根据正确实验结果所绘制的滴定曲线如上图所示,其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。计算醋酸的电离平衡常数___________,CH3COOH的物质的量浓度为__________ mol?L—1。
(1)用pH试纸测定醋酸pH的操作是___________。
(2)常温下在 pH =5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是______ mol?L—1。
(3)用0.1000 mol?L—1NaOH溶液滴定20.00mL某浓度的CH3COOH溶液,部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述实验过程中的错误之处 (填序号)。上述实验与一定物质的量浓度溶液配制实验中用到的相同仪器___________________。
(4)某次滴定前滴定管液面如图所示,读数为________mL。
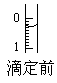

(5)根据正确实验结果所绘制的滴定曲线如上图所示,其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。计算醋酸的电离平衡常数___________,CH3COOH的物质的量浓度为__________ mol?L—1。
(14分)(1) 用镊子夹取一小块试纸放在干燥洁净的表面皿或玻璃片上,用玻璃棒蘸取待测液点在试纸的中部,观察颜色变化,与标准比色卡比对读数(2分)
(2)10—5—10—9(2分)
(3) ①②③(2分) 烧杯(或烧杯和胶头滴管)(2分)
(4)0.30(2分)
(5)1.7×10—5 mol?L—1(2分) 0.1007(2分)
(2)10—5—10—9(2分)
(3) ①②③(2分) 烧杯(或烧杯和胶头滴管)(2分)
(4)0.30(2分)
(5)1.7×10—5 mol?L—1(2分) 0.1007(2分)
(1)考查常见的基本实验操作。测量溶液的pH值的正确方法是用镊子夹取一小块试纸放在干燥洁净的表面皿或玻璃片上,用玻璃棒蘸取待测液点在试纸的中部,观察颜色变化,与标准比色卡比对读数。
(2)常温下在 pH =5的醋酸稀溶液中,氢离子浓度是10—5 mol/L。由于水还存在电离平衡,所以醋酸电离出的c(H+)的精确值是10—5 mol/L—10—9 mol/L。
(3)滴定管在装入标准液之前需要润洗,①不正确;醋酸是弱酸,所以氢氧化钠滴定醋酸时,应该用酚酞试液作指示剂,②不正确;滴定时,边滴加边振荡,同时注视锥形瓶内溶液颜色的变化,③不正确,所以答案选①②③。配制一定物质的量浓度溶液和中和滴定值都需要烧杯。
(4)滴定管的能精确到0.1ml,读数到0.01ml。又因为滴定管的刻度自上而下时逐渐增大的,所以根据液面的位置可知,正确的读数是0.30ml。
(5)①点溶液中氢离子浓度是10—5 mol/L,所以醋酸的电离平衡常数是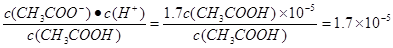 。点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+),所以恰好满足物料守恒,即点③处溶液中溶质是醋酸钠,这说明二者恰好反应,所以根据消耗氢氧化钠溶液的条件是20.14ml可知,醋酸的浓度是0.1000mol/L×20.14÷20=0.1007mol/L。
。点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+),所以恰好满足物料守恒,即点③处溶液中溶质是醋酸钠,这说明二者恰好反应,所以根据消耗氢氧化钠溶液的条件是20.14ml可知,醋酸的浓度是0.1000mol/L×20.14÷20=0.1007mol/L。
(2)常温下在 pH =5的醋酸稀溶液中,氢离子浓度是10—5 mol/L。由于水还存在电离平衡,所以醋酸电离出的c(H+)的精确值是10—5 mol/L—10—9 mol/L。
(3)滴定管在装入标准液之前需要润洗,①不正确;醋酸是弱酸,所以氢氧化钠滴定醋酸时,应该用酚酞试液作指示剂,②不正确;滴定时,边滴加边振荡,同时注视锥形瓶内溶液颜色的变化,③不正确,所以答案选①②③。配制一定物质的量浓度溶液和中和滴定值都需要烧杯。
(4)滴定管的能精确到0.1ml,读数到0.01ml。又因为滴定管的刻度自上而下时逐渐增大的,所以根据液面的位置可知,正确的读数是0.30ml。
(5)①点溶液中氢离子浓度是10—5 mol/L,所以醋酸的电离平衡常数是
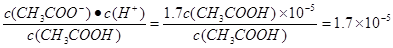 。点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+),所以恰好满足物料守恒,即点③处溶液中溶质是醋酸钠,这说明二者恰好反应,所以根据消耗氢氧化钠溶液的条件是20.14ml可知,醋酸的浓度是0.1000mol/L×20.14÷20=0.1007mol/L。
。点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+),所以恰好满足物料守恒,即点③处溶液中溶质是醋酸钠,这说明二者恰好反应,所以根据消耗氢氧化钠溶液的条件是20.14ml可知,醋酸的浓度是0.1000mol/L×20.14÷20=0.1007mol/L。
练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
 ,其循环过程分三步进行:
,其循环过程分三步进行: