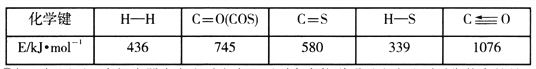
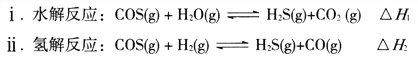题目内容
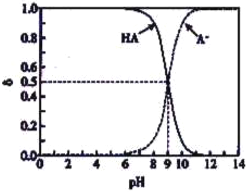
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。

(1)a点(横坐标为10)所示溶液中离子浓度从大到小的顺序为___________________ ,其中c(Na+)______c(A-)+c(HA)(填“>”“<”或“=”)。
(2)c点所示溶液中,c(Na+)_____c(A-)(填“>”“<”或“=”)。
(3)b点所示溶液中,c(A-)_____c(HA)(填“>”“<”或“=”)。
(4)a、b、c点所示溶液中,水的电离程度最大的是__________________________。
(5)以下滴定操作会导致V(HA)偏大的是____________。
A、滴定管滴定前有气泡,滴定后气泡消失
B、锥形瓶洗涤后没有干燥
C、滴定时锥形瓶中有液体溅出
D、滴定开始前读数时平视,滴定终点,读数时俯视
【答案】 c(Na+)>c(A-)>c(OH-)>c(H+) = = > a A
【解析】本题考查离子浓度大小比较、误差分析,(1)a点,消耗HA的体积为10mL,两者恰好完全反应,反应后溶质为NaA,此时溶液显碱性,说明A-为弱酸根离子,发生A-+H2O ![]() HA+OH-,因此离子浓度为c(Na+)>c(A-)>c(OH-)>c(H+);根据物料守恒,c(Na+)=c(A-)+c(HA);(2)c点时,根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(A-),溶液的pH显中性,c(H+)=c(OH-),即c(Na+)=c(A-);(3)b点溶质为NaA和HA,且两种物质的物质的量相等,此时溶液显酸性,说明HA的电离程度大于A-水解程度,即c(HA)<c(A-);(4)a点时,溶质为NaA,A-发生水解,促进水的电离,b、c点时HA过量,对水的电离抑制,因此水的电离程度最大的时a点;(5)A、滴定前有气泡,滴定后气泡消失,V(HA)偏大,故A正确;B、锥形瓶中有无干燥,对实验无影响,V(HA)不变,故B错误;C、锥形瓶有液体溅出,锥形瓶中溶质物质的量减少,消耗HA的体积减小,故C错误;D、滴定前平视读数,滴定终点,俯视读数,消耗V(HA)减小,故D错误。
HA+OH-,因此离子浓度为c(Na+)>c(A-)>c(OH-)>c(H+);根据物料守恒,c(Na+)=c(A-)+c(HA);(2)c点时,根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(A-),溶液的pH显中性,c(H+)=c(OH-),即c(Na+)=c(A-);(3)b点溶质为NaA和HA,且两种物质的物质的量相等,此时溶液显酸性,说明HA的电离程度大于A-水解程度,即c(HA)<c(A-);(4)a点时,溶质为NaA,A-发生水解,促进水的电离,b、c点时HA过量,对水的电离抑制,因此水的电离程度最大的时a点;(5)A、滴定前有气泡,滴定后气泡消失,V(HA)偏大,故A正确;B、锥形瓶中有无干燥,对实验无影响,V(HA)不变,故B错误;C、锥形瓶有液体溅出,锥形瓶中溶质物质的量减少,消耗HA的体积减小,故C错误;D、滴定前平视读数,滴定终点,俯视读数,消耗V(HA)减小,故D错误。

 每课必练系列答案
每课必练系列答案