题目内容
【题目】常温下,HA为一元弱酸。已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如右图所示。向10mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列不正确的是
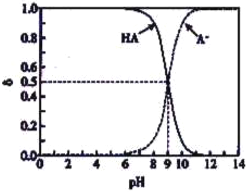
A. 常温下,HA的电离平衡常数Ka=10-9 B. x=0时,1<pH<7
C. x=5时,C(A-)=c(HA) D. x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L
【答案】C
【解析】A. 当pH值为9时,溶液中c(H+)=1×10-9mol/L,由c(HA)= c(A-)得,Ka=10-9,A正确;B. HA为弱酸,当不添加NaOH时,溶液呈酸性,且不完全电离,c(H+)<0.1mol/L,B正确;C. 当x=5时,不能将电离出的H+完全中和,溶液呈酸性,C(A-)与c(HA)不相等,C错误;D. x=10时,溶液体积为20mL,则此时c(A-)+c(HA)=![]() =0.05mol/L,
=0.05mol/L,
c(Na+)![]() =0.05mol/L,D正确。故选择C。
=0.05mol/L,D正确。故选择C。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
|
|
|
|
根据以上规律判断,下列结论正确的是( )
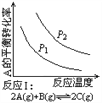
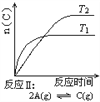
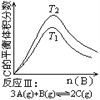
A. 反应Ⅰ:ΔH>0,P2>P1 B. 反应Ⅱ:ΔH<0,T1<T2
C. 反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 D. 反应Ⅳ:ΔH<0,T2>T1